某学生课外活动小组利用下图所示装置分别做如下实验: 
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
一定温度下,在容积为VL的密闭容器中进行aN(g) bM(g) 反应,M、N的物质的量随时间的变化曲线如图所示
bM(g) 反应,M、N的物质的量随时间的变化曲线如图所示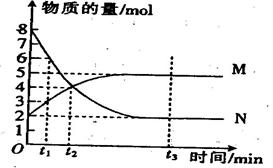
(1)此反应的化学方程式中 =
=
(2)t1到t2时刻,以 M的浓度变化表示的平均化学反应速率为
M的浓度变化表示的平均化学反应速率为
( 3)此反应在该条件下达到限度时,反应物的转化率为
3)此反应在该条件下达到限度时,反应物的转化率为
(4)下列叙述中能说明上述反应达到平衡状态的是。
| A.反应中M与N的物质的量之比为1:1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内消耗a mol N ,同时生成b mol M |
E、混合气体的压强不随时间的变化而变化
F、N的转化率达到最大,且保持不变
A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水;D元素原子的次外层电子数比最外层电子数多4,E元素原子的最外层与最内层电子数的差是3。试回答下列问题:
(1)写出下列元素的元素符号:A,C,D,E。
(2)用电子式表示B和F形成化合物的过程
(3)写出A、C、F三种元素的最高价氧化物对应的水化物相互反应的化学方程式:
(1)X元素的原子核外有2个电子层,其中L层有5个电子,则该元素在周期表中的位置为,其气态氢化物的化学式为,最高价氧化物的化学式为,该元素的最高价氧化物对应水化物的化学式为。
(2)R为1—18号元素中的一种非金属元素,若其最高价氧化物对应水化物的化学式为HnROm,则此时R元素的化合价为,R原子的最外层电子数为,其气态氢化物的化学式为。
菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,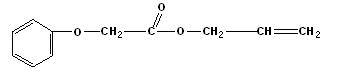
其的合成路线如下: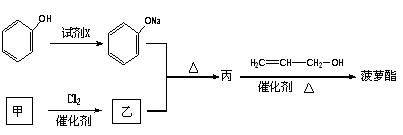
提示: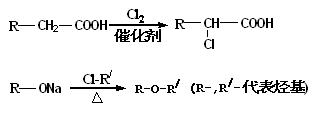
(1)有机物乙中所含有的官能团是_________
(2)上述合成菠萝酯的过程中,下列反应类型中未涉及到的是___________。
| A.取代反应 | B.加成反应 | C.消去反应 | D.中和反应 |
(3)菠萝酯有多种同分异构体,写出同时满足下列三个条件的同分异构体的结构简式。(写出其中的一种即可)
①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色
②除苯环外无其他环状基团
③能与NaOH溶液反应,且1mol该同分异构体最多能与2molNaOH反应___________
(4)写出由丙→菠萝酯的化学化学方程式。______________________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。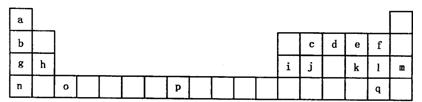
试回答下列问题:
(1)请写出元素o的基态原子电子排布式,g元素的价电子的四个量子数依次是。
(2)d的氢化物中心原子的杂化方式是。
(3)o元素所在族的符号是。
(4)d的氢化物与l的氢化物反应后的产物中包含的化学键是。
(5)f、l、q的氢化物中沸点最高的是。(写化学式)
(6)j原子形成的晶体与j原子跟c原子以1:1相互交替结合而形成的jc晶体类型相同。则j晶体的熔点jc晶体的熔点(填“大于”“等于”“小于”)原因是