将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g) 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是
| A.2 mol SO2+1 mol O2 |
| B.4 mol SO2+1 mol O2 |
| C.2 mol SO2+1 mol O2+2 mol SO3 |
| D.3 mol SO2+1 mol SO3 |
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是:
| A.Y、Z和W三种元素可能位于同一周期 |
| B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
| C.Y和W所形成的含氧酸均为强酸 |
| D.X、Y、Z和W可以组成原子的物质的量之比为5:1:4:1的离子化合物 |
镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高而平稳,因而越来越成为人们研制绿色原电池所关注的重点。有一种镁原电池的反应为:x Mg+Mo3S4放电充电MgxMo3S4。在镁原电池放电时,下列说法错误的是
| A.Mg2+向正极迁移 | B.正极反应为:Mo3S4+ 2xe- = Mo3S42x— |
| C.Mo3S4发生氧化反应 | D.负极反应为:xMg-2xe-=xMg2+ |
某化合物的结构(键线式)及球棍模型如下:
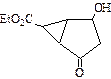 |
 |
该有机分子的核磁共振波谱图如下(单位是ppm)。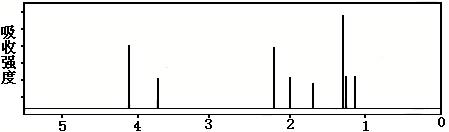
下列关于该有机物的叙述正确的是:
| A.该有机物不同化学环境的氢原子有8种 | B.该有机物属于芳香族化合物 |
| C.键线式中的Et代表的基团为-CH3 | D.该有机物在一定条件下能够发生消去反应 |
已知NO2和N2O4可以相互转化:2NO2(g) N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化
N2O4(g) △H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化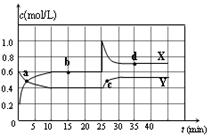
关系如右图。下列说法正确的是
| A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| B.前10 min内用v(NO2)表示的化学反应速率为0.06 mol/(L·min) |
| C.25 min时,导致平衡移动的原因是将密闭容器的体积缩小为1L |
| D.a、b、c、d四个点中,只有b、d点的化学反应处于平衡状态 |
常温下的下列情况中,一定能大量共存于同一溶液中的离子组是
| A.使甲基橙呈红色的溶液中:I-、Cl-、NO3-、Na+ |
| B.使石蕊呈蓝色的溶液中:NH4+、Al3+、NO3-、HCO3- |
| C.由水电离出的c(H+)=1×10 -12mol·L -1的溶液中:K+、Cl-、NO3-、Na+ |
| D.含有大量Al3+的溶液中:K+、Mg2+、Na+、ClO- |