请将体现下列实验操作目的的正确选项,填在对应的横线上。
| A.防止药品污染 | B.防止试管破裂 |
| C.防止实验误差 | D.防止液体溅出 |
(1)加热试管时,先均匀加热,后集中加热
(2)滴管使用后,及时清洗并放在试管架上
(3)量取液体时,视线与凹液面最低处保持平视
(1)按要求写出下列符号:
①2个氧原子____________ ②3个二氧化碳分子____________③铁元素______________
(2)写出下列数字的意义: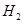 ________________________________
________________________________
已知某化合物的化学式是FexOy,且该化合物中铁元素和氧元素质量比为7:3,则该化合物的化学式为
下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。请你回答: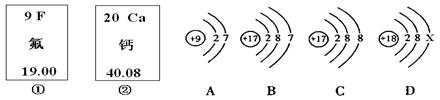
氟元素的相对原子质量为 ,X= ;①和②形成的化合物的化学式为 。A、B、C、D中属于同种元素的粒子是 (填序号)。;
下列是对河水的处理步骤:河水→A(明矾)→B(沉淀)→C(过滤)→D(漂白粉)→净水
(l)可以除去悬浮杂质的步骤是 ,题中的“净水”是(纯净物、混合物) 其原因是 。
(2)下图是实验室中过滤操作示意图.回答下列问题:图中A的名称是 ,在过滤操作中,B的作用是 。过滤时漏斗下端管口应 .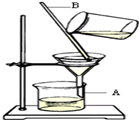
(3)净水剂漂白粉的有效成分是次氯酸钙,它露置在空气中易与空气中的水和二氧化碳作用转化为难溶的碳酸钙和次氯酸而失效,试写出该变化的文字表达式 ;已知高铁酸钠(Na2FeO4)也是目前广泛被应用的净水剂,其中铁元素的化合价是 。
实验室用氯酸钾制取氧气,应选用的气体发生装置是 ,反应的文字表达式是 ,该反应属于化学反应中的反应;若用装置C收集氧气,验满方法是 。若用过氧化氢制氧气,应选用发生装置 ,电解水也能得到氧气,请写出反应的文字表达式 。用装置D采用排水法收集氧气时,气体应从 (c或d)通入。
