已知下列热化学反应方程式:
① Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ΔH =-24.8 kJ/mol
② Fe2O3(s)+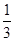 CO(g) =
CO(g) =  Fe3O4(s)+
Fe3O4(s)+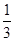 CO2(g) ΔH =-15.73 kJ/mol
CO2(g) ΔH =-15.73 kJ/mol
③ Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) ΔH =+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
| A.-218 kJ/mol | B.-109 kJ/mol |
| C.+218 kJ/mol | D.+109 kJ/mol |
乙醇在发生的下列化学反应里,其分子断裂C—O键而失去羟基的是
| A.乙醇与金属钠的反应 | B.乙醇与氢溴酸的反应 |
| C.乙醇被氧化为乙醛 | D.乙醇与乙酸发生酯化反应 |
下列关于常见有机物的说法不正确的是
| A.乙烯和苯都能与溴水反应 |
| B.乙酸和油脂都能与氢氧化钠溶液反应 |
| C.糖类和蛋白质都是人体重要的营养物质 |
| D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别 |
下列说法正确的是
| A.乙烯和乙烷都能发生加聚反应 |
| B.蛋白质水解的最终产物是多肽 |
| C.米酒变酸的过程涉及了氧化反应 |
| D.石油裂解和油脂皂化都有高分子生成小分子的过程 |
甲、乙两烧杯中各盛有100mL 3mol·L-1的盐酸和氢氧化钠溶液。向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成气体的体积比为1:2,求所加入的铝粉质量为()
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则()
| A.反应过程中得到6.72L的气体(标准状况) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8g的沉淀 |
| D.最终得到的溶液中c(NaCl)=1mol/L |