某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)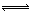 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
| A.该反应的化学平衡常数表达式是K= [ C ]4 [ D ]2 / [ A ]3 [ B ]2 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
常温下硫单质主要以S8形式存在,加热时S8会转化为S6、S4、S2等,当蒸气温度达到750°C时主要以S2形式存在,下列说法正确的是( )
| A.S8转化为S6、S4、S2属于物理变化 |
| B.不论哪种硫分子,完全燃烧时都生成SO2 |
| C.常温条件下单质硫为原子晶体 |
| D.把硫单质在空气中加热到750°C即得S2 |
下列各种说法中一定正确的是( )
| A.过渡金属的原子或离子一般都有接受孤电子对的空轨道,易形成配合物 |
| B.中心原子或离子采取sp3杂化轨道形成的配离子均呈正四面体结构 |
| C.当中心原子或离子的配位数为6时,配离子一定呈八面体结构 |
| D.含有两种配位体且配位数为4的配离子一定存在顺反异构体 |
下列推断正确的是( )
| A.BF3是三角锥形分子 |
B.NH4+的电子式: ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—Hσ键 |
SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为 ( )
| A.6种 | B.7种 | C.10种 | D.12种 |
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。下列对NCl3的有关描述正确的是( )
| A.NCl3是三角锥形结构,故它是非极性分子 |
| B.NCl3分子间可形成氢键,故它比PCl3难挥发 |
| C.NCl3有孤电子对,它还能以配位键的形式再与一个Cl-结合 |
| D.NCl3分子中不存在非极性共价键 |