某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
| A.a=3 | B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是: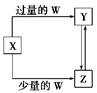
| 选项 |
A |
B |
C |
D |
| X |
C |
Fe |
Ca(OH)2溶液 |
AlCl3 |
| W |
O2 |
HNO3 |
CO2 |
NH3·H2O |
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
| A.②③④⑥ | B.②③⑤ | C.①④⑤ | D.①②③④⑤⑥ |
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是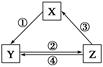
| 选项 |
X |
Y |
Z |
箭头上所标数字的反应条件 |
| A |
CaO |
Ca(OH)2 |
CaCO3 |
①常温遇水 |
| B |
AlCl3 |
NaAlO2 |
Al(OH)3 |
②通入CO2 |
| C |
Na2CO3 |
NaOH |
NaHCO3 |
④过量Ca(OH)2溶液 |
| D |
Cl2 |
Ca(ClO)2 |
HClO |
③加浓盐酸 |
类推是学习和研究的重要思维方法。下列类推结论正确的是
| 化学事实 |
类推结论 |
|
| A |
Al在O2中燃烧生成Al2O3 |
Fe在O2中燃烧也生成Fe2O3 |
| B |
pH=3的盐酸稀释1000倍后pH=6 |
pH=6的盐酸稀释1000倍后pH=9 |
| C |
用电解熔融MgCl2的方法冶炼金属镁 |
用电解熔融NaCl的方法制取金属钠 |
| D |
将SO2通入BaCl2溶液中无沉淀生成 |
将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是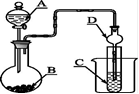
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 |
| C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 |