灰锡(以粉末状存在)和白锡(韧性很好)是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)  Sn(s、白) △H3=+2.1kJ·mol-1
Sn(s、白) △H3=+2.1kJ·mol-1
下列说法正确的是
| A.△H1>△H2 |
| B.锡的两种同素异形体在常温下可以相互转化,是可逆反应 |
| C.灰锡转化为白锡的反应是吸热反应 |
| D.锡制器皿应置于高于13.2℃的环境中,否则会自行毁坏 |
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是
A.非金属性A>B>C
B.气态氢化物稳定性HA>H2B>CH3
C.原子半径A>B>C
D.阴离子还原性C3->B2->A-
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是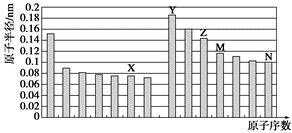
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
下列说法正确的是
A.电子层结构相同的不同离子,其半径随核电荷数增大而减小
B.C、O、S原子半径依次增大,氢化物稳定性逐渐增强
C.ⅠA族元素与ⅦA族元素形成的化合物都为离子化合物
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应的水化物酸性越强
下列判断中一定正确的是
| A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强 |
B.若M+和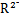 的核外电子层结构相同,则原子半径:R>M 的核外电子层结构相同,则原子半径:R>M |
| C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y |
| D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y |
下列有关原子结构及元素周期律的叙述正确的是
| A.同主族元素的原子最外层电子数相同,化学性质也相同 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.同主族元素从上到下,单质的熔点逐渐降低 |