现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______ _个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______ _。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ mol·l-1。
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。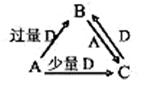
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为。
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为。
②反应B+A→C的离子方程式为。
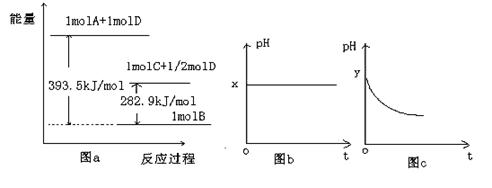
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其PH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D为(填化学式),此时 图b中x 7(填“﹥”“﹤”“﹦”)
图b中x 7(填“﹥”“﹤”“﹦”)
②若图c符合事实,则其PH变化的原因是(用离子方程式表示);已知图c中y﹤7,B的焰色反应为黄色,则B溶液中各离子浓度由大到小的顺序是。
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式:。
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g) + 3H2(g)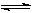 CH3OH(g) + H2O(g)△H=" -49.0" kJ·mol-1
CH3OH(g) + H2O(g)△H=" -49.0" kJ·mol-1
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):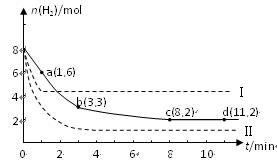
回答下列问题:
(1)该反应在条件下能自发进行(填编号)。
A、高温 B、低温 C、任何温度
(2)该反应在0~8 min内CO2的平均反应速率是mol/(L•min)。
(3)该反应的平衡常数K=。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是,曲线Ⅱ改变的条件可能是。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条
件下平衡常数为K2,则K、K1和K2的大小关系是。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
芳香族化合物A有如下的转化关系:
已知C的结构简式为 ,F能使溴的CCl4溶液褪色。请回答下列问题:
,F能使溴的CCl4溶液褪色。请回答下列问题:
(1)写出结构简式:A;F。
(2)请写出B→D反应的化学方程式:。
(3)检验B中官能团的实验方法是
。
(4)若有机物G与D互为同分异构体,则与有机物B互为同系物的G的同分异构体有种,
任写一种符合此条件的G的结构简式。
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为,还原产物是。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为;阴极观察到的现象是;
现有A、B、C、D、E、F六种物质的溶液,分别为NH3·H2O、NaHSO4、AlCl3、AgNO3、NaAlO2、NaOH中的一种,已知:
①将A溶液逐滴滴加到B溶液中至过量,先出现沉淀,后沉淀溶解;
②将C溶液逐滴滴加到D溶液中至过量,先出现沉淀,后沉淀溶解;
③将E溶液逐滴滴加到F溶液中至过量,先出现沉淀,后沉淀溶解;
④在①和③的反应中出现的沉淀是同一种物质;
⑤A、D、F三种溶液呈酸性。
请回答下列问题:
(1)写出下列化学式:A;D;E。
(2)过量A溶液与B溶液反应的离子方程式为。
(3)将C溶液逐滴滴加到F溶液中至过量,此过程中反应的离子方程式为
。
(4)若A、C的混合溶液呈中性,则该溶液中所有离子的浓度的大小关系为
。