(7分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为_________,参加反应的HCl有______mol。
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度 。
将1molH2和1molI2(g)加入2L密闭容器中进行反应:H2 + I2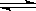 2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
2HI,反应进行到2min时测得反应速率v(HI)=" 0.2mol" /(L·min)。求
(1)用氢气的浓度变化来表示2min内的该反应的平均速率?
(2)2min末I2(g)的物质的量浓度?
0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。(
⑴产物的物质的量为:n(H2O)=mol,n(CO)=mol,n(CO2)=mol。
⑵该有机物的分子式为。
⑶等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物的结构简式为
“鸟语花香”是环境美的标志之一;乙酸乙酯是一种香料,用92g乙醇、30g乙酸和40g浓硫酸均匀混合,在一定温度下充分反应,如果实际产率是理论产率的50℅;
(1)通过计算确定可得到的乙酸乙酯的质量
(2)通过计算确定反应后的混合物中水的质量分数(不考虑物质挥发)
(3)在该实验中,若用1mol乙醇和1mol 乙酸在浓硫酸作用下加热,充分反应,若不考虑反应物的挥发,理论上能否生成1mol乙酸乙酯?(填能或不能),原因是。
(6分)在标准状况下,将11.2L乙烯和乙烷的混合气体缓慢的通入足量的溴水中,充分反应后,溴水的质量增加了5.6g(不考虑物质挥发);
(1)写出有关反应的化学方程式
(2)通过计算确定原气体混合物中乙烯与乙烷气体的物质的量之比和质量比
将10g NaCl和NaI的混合物溶于水后,通入足量的Cl2,将溶液蒸干灼烧得固体6.34g. 求原混合物中NaCl的质量分数。