下列说法正确的是
①已知BaSO4的Ksp=C(Ba2+)·C(SO42-),所以在硫酸钡溶液中有C(Ba2+)=C(SO42-)= mol/L;
mol/L;
②常温下,强酸溶液的PH=a,将溶液的体积稀释到原来的10n倍,则PH=a+n;
③将0.1mol/L的NaHS和0.1mol/L的Na2S溶液等体积混合,所得溶液中有C(S2-)+2C(OH-)=2C(H+)+C(HS-)+3C(H2S);
④在0.1mol/L氨水中滴加0.1mol/L盐酸,恰好中和时PH=a,则由水电离产生的C(OH-)=10-amol/L
| A.①④ | B.②③ | C.③④ | D.①② |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为 ()
| A.3.2mol/L | B.2.8mol/L | C.1.8mol/L | D.缺数据无法计算 |
已知Fe3O4可表示成(FeO· Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O32-+O2+4OH-= Fe3O4 +S4O62-+2H2O 下列说法不正确的是()
| A.O2是氧化剂,S2O32-、Fe2+是还原剂 |
| B.当有1 mol Fe3O4 生成时共转移的电子为4mol |
| C.若有3mol Fe2+参加反应,则被Fe2+还原的O2为1mol |
| D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol |
硫的卤化物(S2X2)是广泛用于橡胶工业的硫化剂,S2C12分子结构如图所示。遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2C12+2H2O=SO2↑+3S↓+4HCl。下列说法中错误的是()
| A.稳定性S2C12>S2Br2 |
| B.反应中,生成1molSO2,转移电子为3mol |
| C.分子中同时含有极性键和非极性键且各原子都满足8电子稳定结构 |
| D.因为S-Cl键能比S-Br键能大,S2C12沸点比S2Br2高 |
下列物质性质的变化规律,与共价键的键能大小无关的是()
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石、碳化硅、晶体硅熔点逐渐降低④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.①④ | C.②③ | D.①②③ |
在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4—5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是()
| A.氯胺水解产物为NH2OH(羟氨)和HCl |
| B.氯胺的消毒原理与漂白粉相似 |
| C.氯胺中氯的化合价为+1 |
D.氯胺的电子式为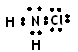 |