已知2H和3H都是制造氢弹的原料。下列关于2H和3H的说法正确的是
| A.2H和3H的质子数不同 | B.2H和3H互为同位素 |
| C.2H和3H是同一种核素 | D.3H原子的电子数为3 |
实验室中欲快速制取氢气,最好的方法应该是()
| A.纯锌与稀硫酸 | B.纯锌与浓硫酸 | C.粗锌与稀硫酸 | D.粗锌与稀硝酸 |
表示正反应是吸热反应的图像是()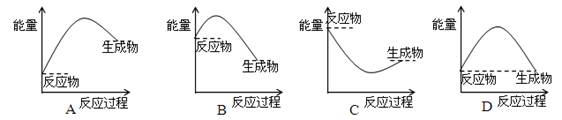
相同质量的下列物质分别与等浓度的NaOH溶液反应至体系中均无固体物质,消耗碱量最多的是:
| A.Al | B.Al(OH)3 | C.AlCl3 | D.Al2O3 |
往含I-和Cl-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为: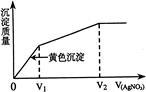
| A.(V2-V1)/V1 | B.V1 / V2 | C.V1 /(V2-V1) | D.V2 / V1 |
某溶液中只含Na+、Al3+、Cl―、SO42―,已知前三种离子的个数比为3 : 2 : 1,则溶液中c(Al3+) 和c(SO42―) 之比为:
| A.3∶4 | B.1∶2 | C.1∶4 | D.3∶2 |