在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入正催化剂
| A.①②③ | B.②③⑤ | C.②⑤ | D.②③④ |
下列用途中没有用到H2SO4酸性的是
| A.实验室制氢气 | B.制硫酸铵 |
| C.干燥氧气 | D.除铁锈 |
(本题共10分)苯是重要的化工原料,以下是某酮酸E的合成路线。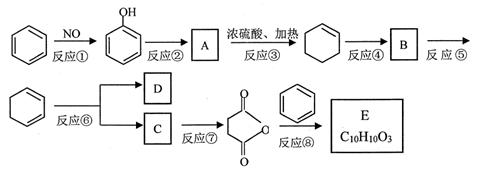

40.以上合成路线中,属于氧化反应的有:反应⑥和反应________(填反应编号);反应⑤的反应条件是_______。
41.写出结构简式A________________; B_____________________
42.己知C的分子式为C4H6O4,则D的结构简式为______________;分离C和D的方法是_________________。
43.不能由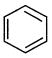 直接制取
直接制取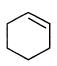 ,原因是______________________________________。
,原因是______________________________________。
44.写出反应⑧的化学方程式_______________________________________________。
磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂。将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是
| A.Na3PO4 | B.Na4P2O7 |
| C.Na4P2O7和Na5P3O10 | D.Na3PO4、Na4P2O7和Na5P3O10 |
25℃时,有v1mL pH=9的氨水(A)和v2mL pH=10的氨水(B),v3mL pH=10的NaOH溶液(C),它们能中和同量的盐酸。以下叙述正确的是
A.v1>10v2
B.加少量水稀释,氨水中c(NH4+)/c(NH3•H2O)都减小
C.v2=v3
D.中和热A=B=C
某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+。以下离子方程式肯定不符合反应事实的是
| A.Mg2++2HCO3-+Ca2++2OH-→MgCO3↓+CaCO3↓+2H2O |
| B.Mg2++2HCO3-+2Ca2++4OH-→Mg(OH)2↓+2CaCO3↓+2H2O |
| C.Mg2++3HCO3-+3Ca2++5OH-→Mg(OH)2↓+3CaCO3↓+3H2O |
| D.Ca2++CO32-→CaCO3↓ |