农村有句谚语“雷雨发庄稼”,这是由于在放电的条件下,空气中的氧气和氮气化合生成了氮的氧化物,氮的氧化物再经过各种复杂的化学变化,最后生成了易被农作物吸收的硝酸盐。
(1)写成有关反应的化学方程式
①
②
③
(2)以上哪个反应属于氮的固定?(填编号),请写出工业固氮的化学方程式
新制氯水呈色,说明氯水中有存在。向氯水中滴入几滴AgNO3溶液,立即有(填现象)生成,说明氯水中有存在,蓝色石蕊试纸遇到氯水后,会首先变红,但很快褪色,说明氯水具有性,氯水光照后,颜色,溶液的酸性,该反应的化学方程式是
己知A的分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。A~H有如下转化关系。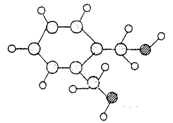

其中A、C、D的相对分子质量有如下关系:M(A)+M(D)= M(C);已知C能与碳酸钠反应放出二氧化碳。C和F、A和H在浓硫酸存在下共热,分别得到有机产物K和J,K和J分子中除苯环外,都含有一个8原子组成的环状结构。
(1)A的分子式为____________________.
(2)J的结构简式为________________________________________,
(3)K和J的关系满足(填序号)
A同类物质 B同分异构体 C同系物
(4)写出下列反应方程式:
反应②
反应④
(5)同时符合“①1mol该物质能和3mol NaOH反应②1mol该物质与足量的银氨溶液反应,生成4mol银单质”两项要求的C的同分异构体的数目为_______ 种,任写出其中的一种的结构简式。
.如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
(1) 丙池是(填“原电池”或“电解池”),甲中a极电极名称是,丙中c极电极名称是;
(2)乙中Cu极的电极反应是______,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为g;
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的化学方程式是;
(4)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L此时测得丙池溶液质量实际减少4.23 g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是mol;
(5)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进。
( 6分)已知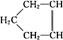 可简写为
可简写为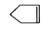 ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为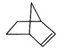
(1)降冰片烯属于__________。
a.环烃 b.不饱和烃 C.烷烃 d.芳香烃
(2)降冰片烯的化学式为__________。
(3)降冰片烯的一种同分异构体(含有一个六元环的单环化合物)的结构简式为__________。
(4)降冰片烯不具有的性质是__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(5)降冰片烯在一定的条件下可以转化为降冰片烷(如图所示),当它发生一氯取代时,取代的位置有__________种。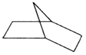
(6)降冰片烷的二氯取代物有__________种