根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是
| A.CO和N2 | B.O3和SO2 | C.CO2和N2O | D.N2H4和C2H4 |
根据表中信息,判断下列叙述中正确的是( )
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
FeBr2 |
/ |
Cl- |
||
| ② |
KClO3 |
浓盐酸 |
/ |
Cl2 |
|
| ③ |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6NA
D.表中③组反应的离子方程式为:2MnO4—+3H2O2+6H+ 2Mn2++4O2↑+6H2O
2Mn2++4O2↑+6H2O
有下列三个反应:
①Cl2+FeI2 FeCl2+I2
FeCl2+I2
②2Fe2++Br2 2Fe3++2Br-
2Fe3++2Br-
③Co2O3+6HCl 2CoCl2+Cl2↑+3H2O,
2CoCl2+Cl2↑+3H2O,
下列说法中正确的是( )
| A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2 |
| B.根据以上方程式可以得到氧化性Cl2>Co2O3>Fe3+ |
| C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 |
D.根据反应①②一定可以推理得到Cl2+FeBr2 FeCl2+Br2 FeCl2+Br2 |
在Cu2S+2Cu2O 6Cu+SO2↑反应中,下列说法中正确的是( )
6Cu+SO2↑反应中,下列说法中正确的是( )
| A.Cu2O在反应中被氧化 |
| B.Cu2S在反应中既是氧化剂又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.若反应中转移12 mol电子,则生成6 mol Cu |
已知Cu+在酸性条件下能发生下列反应:Cu+ Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
Cu+Cu2+(未配平)。NH4CuSO3与足量的1.0 mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是( )
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中铜元素全部被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )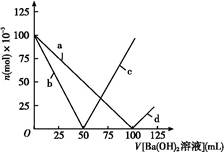
| A.曲线a表示Ba2+的物质的量的变化 |
| B.曲线c表示OH-的物质的量的变化 |
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O BaSO4↓+H2O |
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O H2O |