下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.常压下五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.Y元素的非金属性比W元素的非金属性强 |
尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质。其转化过程如下: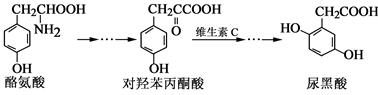
下列说法正确的是
| A.酪氨酸含有1个手性碳原子 |
| B.1 mol对羟苯丙酮酸与足量浓溴水反应,最多消耗4mol Br2 |
| C.可以用氯化铁溶液区别对羟苯丙酮酸和尿黑酸 |
| D.1 mol尿黑酸与足量NaHCO3反应,最多消耗1 mol NaHCO3 |
下列有关说法正确的是
A.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 |
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:下列说法正确的是 ()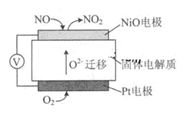
| A.NiO电极发生还原反应 |
| B.Pt电极是电池的负极 |
| C.NiO 电极的电极反应式:NO—2e—+O2—=NO2 |
| D.该电池在标准状况下,若Pt电极消耗2.24L O2,NiO电极电极产生2.24LNO2气体 |
下列表示对应化学反应的离子方程式正确的是
A.HCO3-水解的离子方程式:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
B.碘水中通入适量的SO2:I2+SO2+2H2O===2I-+SO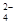 +4H+ +4H+ |
| C.过量的SO2通入NaOH溶液中:SO2—+2OH—=SO32—+H2O |
D.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O===AgOH↓+NH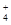 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,11.2 L NO和11.2 L O2混合后气体的分子总数为NA |
| B.标准状况下,由H2O2制得4.48LO2转移的电子数目为0.8NA |
| C.14 g 由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA |
| D.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA |