(1)写出下列物质在水溶液中电离的方程式
HNO3 HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_____________ __________.
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2(g) + O2(g)= 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g)= 2CO2(g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式。
(3)在25℃下,向浓度均为0.1 mol・L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为 中性,则Va︰Vb=。
中性,则Va︰Vb=。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
(7)NH4Cl是一种重要的化肥。
①用0.1 mol·L—1的盐酸滴定0.1 mol·L—1的氨水,滴定过程中不可能出现的结果是:
a.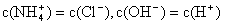
b.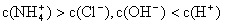
c.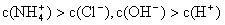
d.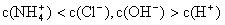
②NH4Cl溶液中存在:NH4+ + H2O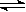 NH3·H2O + H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K=(已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时VA=VB=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:
2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: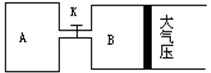
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较: n(W)An(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,
B的体积为升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是。
虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H 2O2 + HF → K2Mn F6 + ____________ + H2O
2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释_______________________________________。
(2)完成反应②:_______________________________________________ 。
。 (3)反应③中的氧化剂为________________,被氧化的元素为________________。
(3)反应③中的氧化剂为________________,被氧化的元素为________________。
(4)配平反应①,并标出电子转移的方向和数目。(将答案写在下面空格上)
________________________________________________________。
某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如下图所示.
mol/L,x与y的关系如下图所示.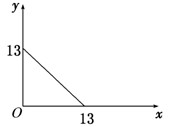
请回答下列问题:
(1)此温度时,水的离子积Kw为 ,则该温度t 25℃(填“>”“<”“=”).
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L
与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小.
①若所得混合液为中性,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
②若所得混合液的pH=2,则a∶b= ;此溶液中各种离子的浓度由大到小排列顺序是 .
下图为常温下向25mL 0.1 mol·L-1 MOH溶液中逐滴滴加0.2 mol·L-1HA溶液过程中溶液pH的变化曲线。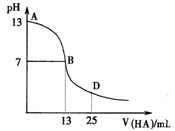
回答下列问题:
(1)上图能确定MOH为(“强”或“弱”)碱,
理由是。
(2)上图能确定HA为(“强”或“弱”)酸,
理由是。
(3)在D点时,溶液中c(A-)+c(HA)2c(M+)。(填“>”、“<”或“=”)