碘与氢气反应的热化学方程式为:
①I2(g)+H2(g) 2HI(g) ΔH=" -" 9.48 kJ·mol-1
2HI(g) ΔH=" -" 9.48 kJ·mol-1
②I2(s)+H2(g) 2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH=" +" 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
| A.反应①的产物比反应②的产物稳定 |
B.I2(s) I2(g)ΔH=" +" 17.00 kJ·mol-1 I2(g)ΔH=" +" 17.00 kJ·mol-1 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ |
X、Y、Z均为元素周期表中前20号元素,mXa+、nYb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是()
| A.已知mXa+与nYb-,得m+a=n-b |
| B.离子半径:Yb->Z(b+1)-﹥Xa+ |
| C.Z(b+1)-的还原性一定大于Yb- |
| D.气态氢化物的稳定性Hb+1Z一定大于HbY |
下列各组物质中化学键的类型完全相同的是 ( )
| A.MgCl2 NH4Cl | B.H2O O2 |
| C.NH3 H2O | D.NaCl HCl |
下列化学用语正确的是()
A.HCl的电子式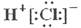 |
B.Cl-的结构示意图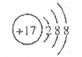 |
C.CO2的电子式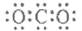 |
D.质量数为37的氯原子37Cl |
等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:()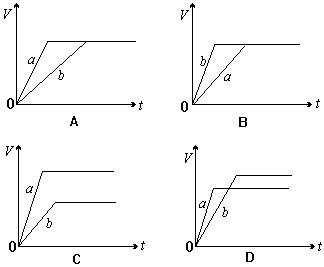
下列物质在一定条件下可与乙烷发生化学反应的是( )
| A.氯气 | B.溴水 | C.氯水 | D.酸性高锰酸钾溶液 |