某KCl、MgCl2、Mg(NO3)2形成的混合中,c(K+)=0.20mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(NO3-)为
| A.0.15mol/L | B.0.10mol/L | C.0.25mol/L | D.0.50mol/L |
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl一、④Br一、⑤SO32一、⑥SO42一离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
下列结论正确的是
| A.不能确定的离子是③⑥ | B.肯定没有的离子是②⑤ |
| C.可能含有的离子是①⑥ | D.肯定含有的离子是③④⑤ |
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO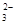 )、c(HCO3¯)都减少,其方法是()
)、c(HCO3¯)都减少,其方法是()
| A.加入氢氧化钠固体 | B.加水 |
| C.通入二氧化碳气体 | D.加入饱和石灰水溶液 |
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
| A.氧化剂与还原剂的物质的量之比为1:8 |
| B.该过程说明Fe( NO3)2溶液不宜加酸酸化 |
| C.若有l mol NO3-发生氧化反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+ |
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
| A.Al2S3、FeS和S |
| B.Fe(OH)3和Al(OH)3 |
| C.Fe2S3和 Al(OH)3 |
| D.FeS、Al(OH)3和S |
某合作学习小组讨论辨析以下说法,其中正确的有
①.豆浆和雾都是胶体;
②.光照氯水有气泡逸出,该气体是Cl2;
③.燃煤时加入适量石灰石,可减少废气中SO2的量;
④.NaHCO3溶液和NaAlO2溶液混合后会产生白色沉淀,是因为二者发生了双水解反应
⑤.氯气易液化,液氯可以保存在钢瓶中;
⑥.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
⑦.液态水分子内存在着氢键,所以其分子比硫化氢分子稳定
⑧.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率加快
| A.2个 | B.3个 | C.4个 | D.5个 |