下列关于溶液物质的量浓度的说法正确的是
| A.把1molNaCl溶于1L水中所得溶液的物质的量浓度为1mol/L |
| B.实验室配制500mL 0.1mol/L的CuSO4溶液,需称取胆矾12.5g |
| C.1L水中溶解224 L HCl气体(标准状况下测得)后形成溶液物质的量浓度为10 mol·L1 |
| D.将7.4克氢氧化钙放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol·L-1 |
在体积恒定的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:
2SO2+O2 2SO3△H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
2SO3△H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
| A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B.降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C.将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D.该反应过程中转移了2mol电子 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:电池 Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)
电解池 2Al + 3H2O = Al2O3 + 3H2,对该电解过程,以下判断正确的是
| 电池 |
电解池 |
|
| A |
H+移向Pb电极 |
H+移向Pb电极 |
| B |
每消耗3molPb |
生成1molAl2O3 |
| C |
正极:PbO2+4H++2e—=Pb2++2H2O |
阳极:2Al+3H2O—6e—=Al2O3+6H+ |
| D |
Pb电极反应质量不变 |
Pb电极反应质量不变 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,脱氧的同时可降低温度,延长糕点保质期 |
| B.脱氧过程中铁做原电池正极,电极反应为:Fe—2e— = Fe2+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e— = 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
下列设备工作时,将化学能转化为热能的是
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是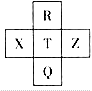
| A.非金属性:Z>T>X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R<T<Q |
| D.R、T、Q的最高正价相同 |