现有0.1 mol·L-1的醋酸溶液,下列说法正确的是
| A.加水稀释,溶液中所有离子的浓度都减小 |
| B.溶液中n(CH3COO— )+n(CH3COOH)=0.1mol |
| C.升高温度,醋酸的电离度增大 |
| D.中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |
下列说法正确的是( )
| A.I的原子半径大于Br,HI比HBr的热稳定性强 |
| B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强 |
| C.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
| D.SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 |
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )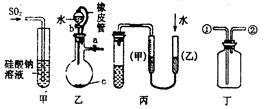
| A.甲装置:可用来证明硫的非金属性比硅强 |
| B.乙装置:橡皮管的作用是能使水顺利流下 |
| C.丙装置:用图示的方法能检查此装置的气密性 |
| D.丁装置:可在瓶中先装入某种液体收集NO气体 |
下表为六种短周期元素的部分性质:
| 元素代号 |
X |
Y |
Z |
Q |
R |
T |
| 原子半径/10-10m |
0.77 |
0.74 |
0.75 |
1.17 |
0.99 |
1.10 |
| 主要化合价 |
+4、-4 |
-2 |
+5、-3 |
+4、-4 |
+7、-1 |
+5、-3 |
下列有关说法错误的是( )
A.X与Y可以形成阴离子XY32-
B.Z的氢化物的沸点比T的氢化物的沸点高
C.元素R的氧化物对应的水化物一定为强酸
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是()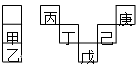
| A.丙与戊的原子序数相差27 |
| B.气态氢化物的稳定性:庚<己<戊 |
| C.丁的最高价氧化物可用于制造光导纤维 |
| D.常温下,甲和乙的单质均能与水剧烈反应 |
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
| A.单质的沸点:W>X | B.氧化物的水化物的酸性:Y<Z |
| C.阴离子的还原性:Y>Z | D.X与Y不能存在于同一离子化合物中 |