(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
烯烃A在一定条件下可以按下图所示进行反应: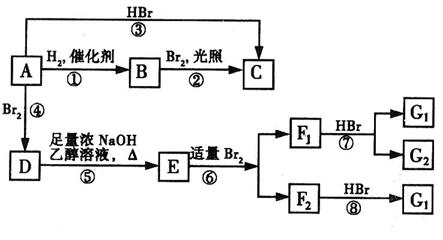
(D是 ,
,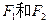 互为同分异构体,
互为同分异构体,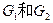 互为同分异构体。)
互为同分异构体。)
请回答下列问题:
(1)A的结构简式是▲;G1的结构简式是▲。
(2)用系统命名法命名有机物B,B的名称是▲。
(3)框图中属于取代反应的是▲。(填数字代号)
(4)E→F2的化学反应方程式▲,属于▲反应。
现有A、B、C、D、E、F六种短周期元素,在化学反应中均能形成简单的阴离子或阳离子,且A、B、C、D离子具有相同的电子层结构。已知:
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的氧化物既能溶于NaOH溶液,又能溶于盐酸;
③C的氢化物分子G是具有10电子的微粒,且可以发生下列转化: G P Q M+P;
G P Q M+P;
④E和D是同主族元素,二者能形成微粒的个数比为1:2和1:3的化合物T和K;
⑤B和D可形成微粒个数比为1:1和2:1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ▲ ;(2)E元素的原子结构示意图是 ▲ 。
(3)请将C的元素符号填在如图所示的元素周期表的适当位置上。
|
烷基取代苯( )可以被酸性KMnO4溶液氧化生成
)可以被酸性KMnO4溶液氧化生成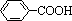 ,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子没有C—H键,则不容易被氧化得到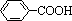 。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为
。现有分子式是C11H16的烷基一取代苯,则它可以被氧化成为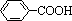 的同分异构体共有 ▲种,并写出一种不能被氧化成为
的同分异构体共有 ▲种,并写出一种不能被氧化成为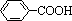 的同分异构体的结构简式 ▲。
的同分异构体的结构简式 ▲。
已知,在常温常压条件下,氢气的热值为143kJ/g,请写出该条件下H2燃烧的热化学方程式 ▲。
已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
A甲+H2O 乙+丙 B乙
乙+丙 B乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表里的位置是_____________。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为__________。
③将以上两种金属单质用导线连接,插入NaOH溶液构成原电池,则负极发生的电极反应为___________________________。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙 丙。则:
丙。则:
①甲的结构式为_____________。
②写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式________________________。