黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2=== +2FeS+SO2(已配平),则下列关于该反应的说法错误的是
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是
| A.方框中的物质应为Cu2S |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中SO2既是氧化产物又是还原产物 |
| D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 实验操作 |
实验目的或结论 |
|
| A |
某钾盐溶于盐酸,产生能使澄清石灰水 变浑浊的无色无味气体 |
说明该钾盐是K2CO3 |
| B |
向含有少量FeCl3的MgCl2溶液中加入足量 Mg(OH)2粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中 少量FeCl3 |
| C |
常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
说明常温下 Ksp(BaCO3)< Ksp(BaSO4) |
| D |
C2H5OH与浓硫酸170 ℃共热,制得的气体 通入酸性KMnO4溶液 |
检验制得气体是 否为乙烯 |
有M、N两溶液,各含下列14种离子中的7种:Al3+、Cl-、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、AlO2-、CO32-、NH4+、SO42-、H+。已知两溶液所含离子各不相同,M溶液里的阳离子只有两种,则N溶液里的阴离子可能是
| A.OH-、S2-、CO32- | B.MnO4-、SO42-、NO3- |
| C.Cl-、NO3-、SO42- | D.AlO2-、MnO4-、SO42- |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1∶6 | B.1∶7 | C.2∶11 | D.16∶25 |
以下数值大于或等于阿伏加德罗常数的是
| A.4.8g石墨中的共价键数目 |
| B.250 mL 1 mol·L-1FeCl3溶液中,阴、阳离子总数 |
| C.一定条件下,将1mol SO2和0.5 mol O2充入一密闭容器内,充分反应后的生成物分子数 |
| D.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
设NA为阿伏伽德罗常数的值,下列说法错误的是
A.1 mol 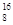 OD- 含有的质子、中子数均为9NA OD- 含有的质子、中子数均为9NA |
| B.3.6 g石墨和C60的混合物中,含有的碳原子数为0.3NA |
| C.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| D.标准状况下,4.48 L HF含有的分子数为0.2NA |