用下列实验装置能达到实验目的的是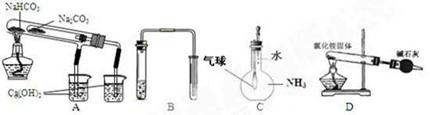
| A.比较NaHCO3和Na2CO3热稳定性大小 |
| B.用铜和稀硝酸制取并收集少量NO |
| C.验证氨气在水中溶解度的大小 |
| D.实验室用氯化铵制少量氨气 |
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2下列说法正确的是:
| A.常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数 |
| B.常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17mol2·L-2 |
| C.常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L |
| D.向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.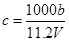 |
B.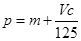 |
| C.n="m+17V" c | D.5/3 m< 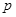 < <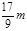 |
如图判断,下列说法正确的是
| A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+ |
| B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH- |
| C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动 |
| D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大 |
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
| 810 |
54.0 |
a |
b |
| 915 |
c |
75.0 |
d |
| 1000 |
e |
f |
83.0 |
下列说法错误的是:
A.b<f
B.915℃、2.0MPa时E的转化率为50%
C.该反应的△S>0
D.K(1000℃)>K(810℃)
下列比较不正确的是
| A.等浓度的NH4HSO4、 NH3·H2O、 (NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的五种溶液,其中(NH4)2Fe(SO4)2溶液中c(NH4+)最大 |
| B.NaClO和BaCl2混合溶液: c(Na+)+2c(Ba2+)=c(ClO-)+c(HClO)+c(Cl-) |
| C.25 ℃下,0.2 mol·L-1 HCl溶液与0.2 mol·L-1 YOH(一元弱碱)溶液等体积混合(忽略混合后溶液体积的变化),则c(Cl-)=c(Y+)+c(YOH)=0.2 mol·L-1 |
| D.常温下,将0.2 mol·L-1某一元碱ROH溶液和0.1 mol·L-1HCl溶液等体积混 合,混合后溶液pH<7,则c(ROH)>c(R+) |