某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: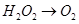
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填“稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的氢化物A2H2分子的空间构型为__________,其中心原子采取的杂化形式为___________,分子中含有___________个 键,__________π键。
键,__________π键。
(2)写出化合物DC的电子式_______,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
如何降低大 气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________________________.
②下列措施中一定不能使CO2的转化率增大的是________________。
| A.在原容器中再充入1molCO2 | B.在原容器中再充入1molH2 |
| C.在原容器中充入1mol氦气 | D.使用更有效的催化剂 |
E.缩小容器的容积 F.将水蒸气 从体系中分离
从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_____________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是_________(填“甲醇”或
“氧气”),其电极上发生的电极反应式为_____________。
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13. 向BaCl2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为___________。
下图为一些物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
请回答下列问题:
(1)工业上利用反应①生产化合物C,得到化合物C的电极名称是______________。
(2)化合物F中阴离子的电子式为_______________。
(3)反应②的化学方程式为____________________。
(4)反应⑤的离子方程式为_________ __________________。
__________________。
(5)高铁酸钠(Na2FeO4)既能杀菌消毒又是一种“绿色环保高效”的净水剂,其原因为:
①_______________________________________________________。
②_______________________________________________________。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是 16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+H2SO4(80%) Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
【注:80%H2SO4具有浓硫酸的特性】
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~D装置中选择最合适的装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是___________、_____________、_____________。
(2)在实验中“加热催化剂”与“滴加浓硫酸”的操作,首先应采取的操作是___________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法。
①原因__________________________________________________.
验证方法________________________________________________.
②原因__________________________________________________.
验证方法________________________________________________.
(4)将足量SO2通入含1.0mol次氯酸的溶液中,有1.204×1024个电子转移,生成两种强酸,该反应的化学方程式为______________________________。
(5)用25.2gNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间将反应产生的SO2全部排出,测得装置Ⅲ增重了3.2g,则SO2的转化率为__________。
已知丙酮与柠檬醛在一定条件下反应可以合成假紫罗兰酮,再进一步可以合成有工业价值的紫罗兰酮,如:
下图是合成有机物A的路线图,反应条件和一些不必列出的产物等均已删去。
(1)⑥中官能团的名称是。
(2)写出结构简式②⑤⑥。
(3)写出化学方程式①→②,反应类型;
⑤→⑥,反应类型。
(4)⑤的某种同分异构体符合下列条件,写出所有可能的结构简式。
a.无支链 b.能发生银镜反应 c.核磁共振氢谱有四组吸收峰