(12分)(1)用50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题: 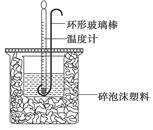
①烧杯间填满碎泡沫塑料的作用是 。
②若大烧杯上改为盖薄铁板,求得的反应热数值: (填“偏大”、“偏小”或“无影响”)
③若通过测定计算产生的热量为1.42kJ,请写该反应的热化学方程式: 。
(2)①已知:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为: 。
②由气态基态原子形成1 mol化学键释放的最低能量叫键能。已知表中所列键能数据, 则
N2(g)+3H2(g) 2NH3(g) ΔH= kJ·mol-1。
2NH3(g) ΔH= kJ·mol-1。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能kJ·mol-1 |
436 |
391 |
945 |
③一定条件下,在水溶液均为1 mol以下离子 Cl-、ClO-、ClO2-、ClO3-、ClO4-的能量(kJ)相对大小如下图所示,则3ClO-(aq)===ClO3-(aq)+2Cl-(aq)的ΔH= kJ·mol-1。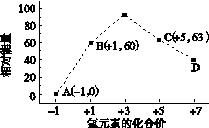
(12分,每空3分)请根据下面的反应路线及所给的信息,用中学化学知识回答问题:
已知A是一种直链一溴代物,1molA与1molH2反应生成1molG,F是环状化合物,环上有5个原子,其化学式为C4H6O2。
(1)化合物F的结构简式是______________,化合物C的结构简式是_____________。
(2)化合物A含有的官能团是__________________________。
(3)1molA与2molG的化学方程式是___________ ______________。
(12分,每空3分)已知:X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是
(2)Z2Y2与X2Y反应的化学方程式是 。
(3)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:C(Ⅰ)的电极名称是 (填写正极或负极);
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子
|
方程式是: 。
| 得分 |
阅卷人 |
(12分,每空3分).
请回答下列问题:
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H=KJ·mol-1;
某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是。
(2)该反应中,发生还原反应的过程是→。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为。
(8分,每空1分)下列各组物质:① O2和O3② H2、D2、T2③12C和14C④CH3OCH3和CH3CH2OH⑤乙炔和丁炔⑥淀粉和纤维素
其中(1)互为同系物的是,(填序号,序号不重复使用,下同)
(2)互为同分异构体的是,
(3)互为同位素的是,
(4)互为同素异形体的是,