已知热化学方程式2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ/mol,则关于热化学方程式2H2O(l)===2H2(g)+O2(g) ΔH2=?的说法正确的是
| A.热化学方程式中化学计量数表示分子数 |
| B.该反应ΔH2大于零 |
| C.该反应ΔH2=-571.6 kJ/mol |
| D.该反应与上述反应属于可逆反应 |
某温度时,N2+3H2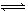 2NH3的平衡常数K="a," 则此温度下,NH3
2NH3的平衡常数K="a," 则此温度下,NH3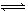 3/2H2+1/2N2的平衡常数为
3/2H2+1/2N2的平衡常数为
A.aˉ1/2 B.a1/2 C.1/2a D.aˉ2
下列反应的能量变化与其他三项不相同的是
| A.铝粉与氧化铁的反应 | B.氯化铵与消石灰的反应 |
| C.锌片与稀硫酸反应 | D.钠与冷水反应 |
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是()
A.CH3COOH(aq)+NaOH(aq)="==" CH3COONa(aq)+H2O(l)  H= H= 57.3kJ/mol 57.3kJ/mol |
B.KOH(aq)+ H2SO4(aq)= H2SO4(aq)=  K2SO4(aq)+H2O(l) K2SO4(aq)+H2O(l) H= H= 57.3kJ/mol 57.3kJ/mol |
C.2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1) H= H= 11036 kJ/mol 11036 kJ/mol |
D.C8H18(l)+  O2 (g)=8CO2 (g)+ 9H2O(g) O2 (g)=8CO2 (g)+ 9H2O(g) H= H= 5518 kJ/mol 5518 kJ/mol |
下列有关叙述中正确的是()
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质的水溶液导电能力不一定比弱电解质水溶液的导电能力强 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质在水溶液中的电离过程是不可逆的 |
密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)  zC(g),平衡时,测得A的浓度为0.80mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述正确的是()
zC(g),平衡时,测得A的浓度为0.80mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述正确的是()
| A.平衡向逆反应方向移动 | B.x + y < z |
| C.B的转化率降低 | D.C的体积分数增大 |