对于反应:2SO2(g)+O2(g)  2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO3 | D.降低体系温度 |
对可逆反应4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g),下列叙述正确的是()
4NO(g) + 6H2O(g),下列叙述正确的是()
| A.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,4v正(O2) = 5v逆(NO) |
| D.化学反应速率关系是:2v正(NH3) = 3v正(H2O) |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=20,由此推测在450℃时,反应
2HI(g)的K=20,由此推测在450℃时,反应
2HI(g)  H2(g)+I2(g)的化学平衡常数为()
H2(g)+I2(g)的化学平衡常数为()
| A.20 | B.0.02 | C.0.05 | D.无法确定 |
已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)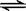 4H2(g)+2CO(g) ΔH=+255.6 kJ·mol-1
4H2(g)+2CO(g) ΔH=+255.6 kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)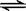 3H2(g)+2CO(g) ΔH=+13.8 kJ·mol-1,则下列说法不正确的是( )
3H2(g)+2CO(g) ΔH=+13.8 kJ·mol-1,则下列说法不正确的是( )
| A.降低温度,可提高b路线中乙醇的转化率 |
| B.从能源消耗的角度来看,b路线制氢更加有利 |
| C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源 |
| D.由a、b知:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 |
在1200℃时,天然气脱硫工艺中会发生下列反应
则△H4的正确表达式为()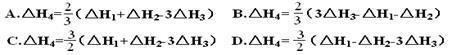
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O,和O==O键的键焓△H分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是()
| A.H2O(g)=H2(g)+1/2O2(g)ΔH=-485KJ/mol |
| B.H2O(g)=H2(g)+1/2O2(g)ΔH=+485KJ/mol |
| C.H2(g)+1/2O2(g)=H2O(g) ΔH=-485KJ/mol |
| D.2H2(g)+O2(g)=2H2O(g) △H=-485KJ/mol |