下列离子方程式正确的是
| A.NaHSO3溶液与NaOH溶液反应:H++OH-=H2O |
| B.少量二氧化碳通入足量的NaOH溶液中:CO2+OH-=HCO3- |
| C.Fe与盐酸反应产生氢气:2Fe+6H+=2Fe3++3H2↑ |
| D.氨水与醋酸溶液混合:NH3·H2O+CH3COOH=NH4++CH3COO-+H2O |
下列图示与对应的叙述相符的是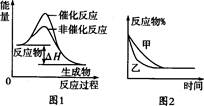
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,甲的压强比乙的压强大
3C(g)+D(s)的影响,甲的压强比乙的压强大
C.图3表示A、B两物质的溶解度随温度变化的情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
下列说法或表示方法正确的是
| A.已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出的c(H+)大于HCN中水电离出的c(H+) |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ/mol,可知,金刚石比石墨稳定 |
| C.向2.0 ml浓度均为0.1 mol/L的KCl、KI混合溶液中滴加1~2滴0.01 mol/L AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1)△H=一285.8 kJ·mol-1 |
下列关于各图的叙述中正确的是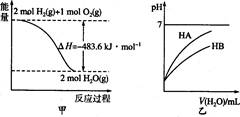
A.图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ
C.图乙表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH
D.图乙中起始时HA的物质的量浓度大于HB
下列说法正确的是
| A.烧碱固体在水中溶解的过程是放热反应 |
| B.P2O5和CaO可以作干燥剂,利用了它们具有易潮解的性质 |
| C.FeCl3固体溶于蒸馏水可制得FeCl3溶液 |
| D.粗盐易潮解是因为其中含有CaCl2和MgCl2等杂质的缘故 |
下列与实验相关的叙述中正确的是
| A.加热NH4Cl晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 |
| B.向某溶液中加入足量盐酸酸化,无明显现象,再加入BaCl2溶液,有白色沉淀生成,说明原溶液中存在SO42一 |
| C.酸碱中和滴定实验中用到的玻璃仪器仅有酸式滴定管、碱式滴定管和烧杯 |
| D.用量筒量取20 mL0.5 mol/L H2SO4溶液于烧杯中,加水80 mL,配制成0.1 mol/L H2SO4溶液 |