下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同
②标准状况下,1 g H2和14 g N2的体积相同
③28 g CO的体积为22.4 L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
| A.①②③ | B.②⑤⑥ | C.②③⑥ | D.④⑤⑥ |
关于反应Fe2O3+3CO  2Fe+3CO2的下列说法中正确的是
2Fe+3CO2的下列说法中正确的是
①Fe2O3发生氧化反应②Fe2O3是氧化剂③Fe是还原产物
④CO具有氧化性⑤该反应属于置换反应
| A.②③⑤ | B.只有①② | C.只有②③ | D.①③④ |
设NA代表阿伏伽德罗常数的值,下列说法正确的是
| A.标准状况下,22.4L水所含的分子数为NA |
| B.17g NH3中所含的原子个数为4NA |
| C.1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA |
D.在反应2H2O2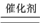 2 H2O+O2↑中每生成1mol O2转移的电子数为NA 2 H2O+O2↑中每生成1mol O2转移的电子数为NA |
下列有关物质存放方法错误的是
| A.金属钠存放于煤油中 | B.Na2O2长期放置在烧杯中 |
| C.铝片长期放置在不密封的纸盒里 | D.浓硝酸溶液存放棕色试剂瓶中 |
在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的
| A.Ba(OH)2溶液 | B.NaOH溶液 | C.氨水 | D.硫酸 |
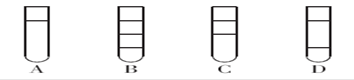
将体积比为1∶2的四氯化碳和碘水在试管中充分混合后静置。下列图示现象正确