(1)质子数是17,中子数是20,其原子组成表示为
(2)由1H216O与2H217O所代表的物质中,共有 种元素, 种原子。
(3)现有11.0g 由 和
和 组成的水分子,其中含中子数为 mol,电子数为- mol。
组成的水分子,其中含中子数为 mol,电子数为- mol。
甲、乙、丙是三种常见的单质,X、Y、Z是它们的化合物,它们之间有如下图所示的转化关系: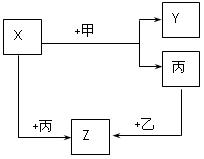
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是;
②写出Y的电子式;
③写出X与甲反应的化学方程式,并标出电子转移的方向和数目:
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z
具有相同的阳离子,X与Z含有相同的离子。
①写出乙物质的化学试;
②写出X与足量的甲在溶液中完全反应的离子方程式:
将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷酸。经科学研究表明,磷酸和多磷酸的结构分别为: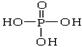 (磷原子几乎处在四面体的中心,三个羟基性质几乎完全相同)
(磷原子几乎处在四面体的中心,三个羟基性质几乎完全相同)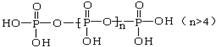
交换后的溶液用0.1 mol·L-1的NaOH溶液滴定。在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点。请回答:
⑴有2个滴定终点的原因是。
⑵n的值为,写出计算依据。
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气态,其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合,有关的转化关系如下图所示(反应条件均已略去)回答下列问题:
⑴Z分子的空间构型为
⑵反应③中被氧化的物质与被还原的物质的物质的量之比为。
⑶Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的方程式为。
⑷将过量的E加到N的稀溶液中,若过程中转化的电子数目为3.02×1023个,则参加反应的E的物质的量为mol。
⑸将Z和N反应后的产物溶于水中,则溶液的pH值(填“<”或“>”)7,其原因是(用离子方程式表示)。
某一反应体系中反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
(1)该反应中还原剂是;(2)该反应中还原产物是;
(3)若反应过程中转移了0.3mol电子,则生成水的质量是g。
某待测溶液(阳离子为Na+)中只可能含有 、
、 、Cl-、Br-、
、Cl-、Br-、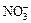 、
、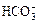 中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
中的一种或若干种,进行下列实验(每次实验所加试剂均足量):
回答下列问题: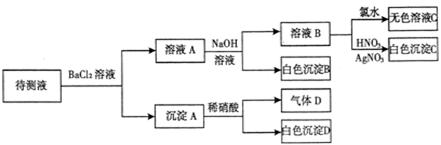
(1)待测液中是否含 、
、 离子
离子
(2)气体D的化学式为,反应生成沉淀B的离子方程式为:
(3)根据以上实验,待测液中肯定没有的离子;肯定存在的离子是。