以下是对某溶液进行离子检验的方法和结论,其中正确的是
| A.先加入BaCl2溶液,产生白色沉淀,再加入HNO3溶液,白色沉淀不溶解,则溶液中一定含大量的SO42- |
| B.加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- |
| C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| D.先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀,则溶液中一定含有大量的Cl- |
在一定条件下,可逆反应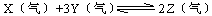 ,达到平衡时有50%的Y转化为Z,若此时X的转化率为25%,则起始充入容器的X与Y物质的量之比应为
,达到平衡时有50%的Y转化为Z,若此时X的转化率为25%,则起始充入容器的X与Y物质的量之比应为
()
| A.3∶2 | B.1∶2 | C.2∶3 | D.1∶3 |
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,其工作原理如下图所示。下列关于固体燃料电池的有关说法正确的是()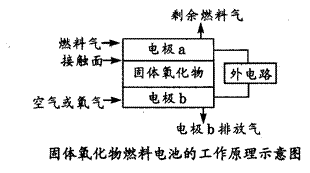
A.电极b为电池负极,电极反应式为:O2+4e-=2O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,接触面上发生的反应为:H2+2OH--2e-= 2H2O
D.若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2--12e-= 2CO2+2H2O
右图是698K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是()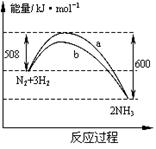
A.该反应的热化学方程式为:N2+3H2 2NH3△H=-92kJ·mol-1 2NH3△H=-92kJ·mol-1 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.温度、体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2 |
和6 molH2反应后放出的热量为Q2kJ则184>Q2>2Q1
下列离子方程式书写正确的是()
| A.锌粒溶于醋酸溶液: Zn + 2CH3COOH = Zn2+ + 2CH3COO-+ H2↑ |
| B.石灰水与足量的小苏打溶液混合: Ca2++OH-+HCO  =CaCO3↓+H2O =CaCO3↓+H2O |
| C.SO2气体通入到硝酸钡溶液中: Ba2++SO2+H2O=BaSO3↓+2H+ |
| D.AlCl3溶液加入NaAlO2溶液: |
Al3++3AlO +3H2O=4Al(OH)3↓
+3H2O=4Al(OH)3↓
下列关于纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是()
| 纯净物 |
混合物 |
强电解质 |
弱电解质 |
非电解质 |
|
| A |
大理石 |
玻璃 |
氯化钾 |
高氯酸 |
二氧化碳 |
| B |
冰醋酸 |
漂白粉 |
小苏打 |
氟化氢 |
氨气 |
| C |
明矾 |
硅酸盐水泥 |
苛性钠 |
亚硫酸 |
熟石灰 |
| D |
纯盐酸 |
水煤气 |
硫酸 |
醋酸 |
氯气 |