常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol·L-1CH3COONa溶液:H+、Al3+、Cl-、NO3- |
| B.含有NaNO3的溶液:H+、Fe2+、SO42- 、Cl- |
| C.能使甲基橙变红的溶液:K+、Na+、NO3-、Cl- |
| D.由水电离产生的c(H+)=10-12 mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
从平时学生实验中我们发现,同学们在进行实验时出现许多不正确的操作方式,希望 同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作
同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作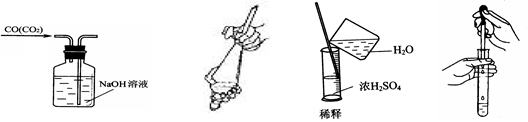

| A.除去CO的CO2 | B.萃取时振荡混合液 | C.稀释浓硫酸 | D.向试管中滴加液体 |
研究物质的组成和结构,常要对物质进行分离和提纯。下列装置或操作一般不用于物质分离提纯的是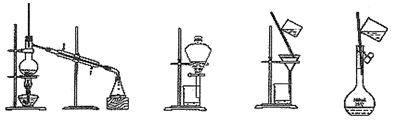
A. B. C. D.
下列操作中正确的是
| A.用25 mL量筒量取4.0 mol/L的盐酸5.62 mL |
| B.用托盘天平称取5.56 g KCl固体 |
| C.配制450 mL 0.2 mol/L H2SO4溶液时应选用500 mL容量瓶 |
| D.分液漏斗使用前需检查是否漏水,分液结束后漏斗中的上层液体从下口放出。 |
食盐分散到酒精中形成直径在1nm~l00nm之间的超细粒子,这样的分散系是
| A.悬浊液 | B.溶液 |
| C.胶体 | D.乳浊液 |
列物质中属于电解质的是
| A.Cu | B.C2H5OH(乙醇) |
| C.Na2SO4 | D.CO2 |