25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.1 L 0.1 mol·L-1 (NH4)2Fe(SO4)2·6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) |
| B.0.1 mol·L-1的NH4Cl与0.1 mol·L-1的NH3·H2O等体积混合:c(NH4+)+2c(H+)=c(NH3·H2O)+2c(OH-) |
| C.pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D.0.1 mol·L-1 CH3COONa 溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
下列说法正确的是
| A.明矾水解形成的Al(0H)3胶体能杀菌消毒,可用于水的净化 |
| B.镀锡的铁制品比镀锌的铁制品耐用 |
| C.乙醇和乙酸都能溶于水,都是电解质 |
| D.分别与等物质的量的HCl和CH3COOH恰好中和时,消耗NaOH的物质的量相同 |
有关常温下pH均为3的醋酸和硫酸的说法正确的是
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
下列叙述正确的是
| A.SO2是电解质,其水溶液能导电 |
| B.酸式盐的水溶液一定呈酸性 |
| C.常温时水电离出的c(H+)=10-4 mol/L的溶液,不可能是稀盐酸 |
| D.常温时纯水的电离平衡常数为1.0×10-14 |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):C(Na+)=c(HRO3-)+2c(RO32-) |
| C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③ |
| D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H+):①>③>② |
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
| A.相同条件下,MnS的Ksp比CuS的Ksp大 |
B.该反应的平衡常数K=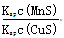 |
| C.该反应达到平衡时c(Mn2+)=c(Cu2+) |
| D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |