为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:
(1)用下图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2),B中预 期的实验现象是 。
(2)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ•mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填
“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe NaNO2
NaNO2 5NaOH → 3Na2FeO2
5NaOH → 3Na2FeO2 H2O
H2O NH3↑
NH3↑
②Na2FeO2 NaNO2
NaNO2 H2O →Na2Fe2O4
H2O →Na2Fe2O4 NH3↑
NH3↑ NaOH
NaOH
③Na2FeO2 Na2Fe2O4
Na2Fe2O4 2H2O
2H2O Fe3O4
Fe3O4 4NaOH
4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为,被还原的是。若有1mol Na2FeO2生成,则反应中有mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是…………………………………………()
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:。
已知由有机物B、苯甲醛、乙酸、乙醇合成目标产物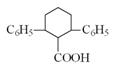 ,其合成路线如下图所示(其中Et表示乙基)。
,其合成路线如下图所示(其中Et表示乙基)。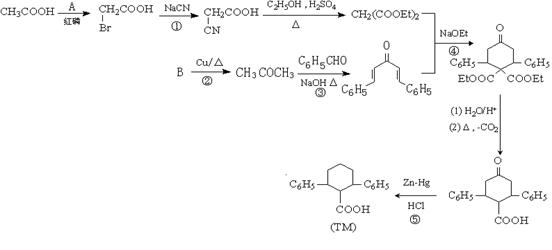
完成下列填空:
(1)写出反应类型:反应④、反应⑤
(2)写出物质A的分子式________ ,B的名称是。
(3)写出下列反应的化学方程式:
②____________________________________________________________。
③___________________________________________________________。
(4)C9H10O是苯甲醛的同系物,其中苯环上含有两个取代基的同分异构体共有____种,写出
其中一种的结构简式_____________________。
(5)如果只用一种试剂通过化学反应(必要时可以加热)鉴别合成原料中的乙酸、乙醇、苯甲醛。这种试剂是______________,其中苯甲醛检出的现象是_______________________。
(6)目标产物(结构如图)是否有含三个苯环的同分异构体____(填“有”或“无”),理由是__________________。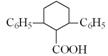
有一种线性高分子,结构如下图所示。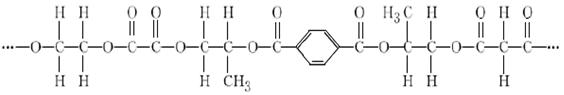
完成下列填空:
(1)该高分子由______种单体(聚合成高分子的简单小分子)聚合而成。这些单体含有的官
能团名称是___________________。
(2)写出上述单体中式量最小和式量最大的分子间发生缩聚反应的化学方程式
__________________________________________________。
(3)上述单体中式量最小的分子在一定条件下完全消去后所得物质的结构简式为
。该物质加聚生成的高分子(填“能”或“不能”)________与溴的CCl4溶液
发生加成反应。该物质三分子聚合成环,所得物质的名称是_______。
(4)上述单体中其中互为同系物的是(写出所有可能,用结构简式表述)
________________________、________________________________________。
工业上高纯硅可以通过下列反应制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量g。
(2)该反应的平衡常数表达式K=。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO。完成下列填空:
(1)该反应中氧化剂是_________,氧化产物是_________。
(2)写出该反应的化学方程式____________________________________________。
(3)每消耗24.0g碳时,有mol电子发生转移,生成P4_______g。
(4)反应所得混合气体,折算成标况下,其气体密度为g/L。