下列表示对应化学反应的离子方程式正确的是
| A.过氧化钙固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+==I2+2H2O |
| C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O |
| D.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2—+4NH4++2H2O |
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2 CH3OH (g) CH3OCH3(g)+H2O(g),则下列说法正确的是
CH3OCH3(g)+H2O(g),则下列说法正确的是
| 容器 编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH (g) |
CH3OCH3(g) |
H2O (g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
||
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
A.该反应的正方向应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g) Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是
Y(g)+W(g)的进行情况。其中实验Ⅰ、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是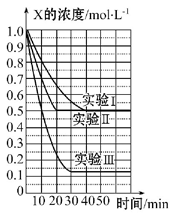
| A.与实验Ⅰ相比,实验Ⅱ可能使用了催化剂 |
| B.与实验Ⅰ相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应 |
| C.在实验Ⅰ、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同 |
| D.若起始浓度c(X)=0.8 mol·L-1,c(Y)=c(W)=0,其余条件与实验Ⅰ相同,则平衡浓度c(X)=0.4 mol·L-1 |
一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g) xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
| A.反应方程式中的x=l |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t1~t3间该反应的平衡常数均为4 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+ 3Y2(g) 2XY3(g)△H=-92.6 kJ.mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g)△H=-92.6 kJ.mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 |
起始时各物质物质的量/mol |
达到平 衡的时间 |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
|||
| ① |
1 |
3 |
0 |
2分钟 |
放热46.3kJ |
| ② |
0.4 |
1.2 |
1.2 |
/ |
Q(Q>0) |
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)="1/30" mol·L-1·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
用CO合成甲醇(CH3OH)的热化学方程式为CO(g)+2H2(g) CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是
| A.温度:T1>T2>T3 |
| B.正反应速率:v(a)>v(c),v(b)>v(d) |
| C.平衡常数:K(a)>K(c),K(b)=K(d) |
| D.平均摩尔质量:M(a)<M(c),M(b)>M(d) |