NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.02mol•L—1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如下图。据图分析,下列判断不正确的是
| A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3反应速率相等 |
| C.图中a点对应的NaHSO3反应速率为5.0 ×10—5mol·L—1·s—1 |
| D.温度高于40℃时,淀粉不宜用作该实验的指示剂 |
已知在1×105 Pa,298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
| A.H2O ( g ) = H2 ( g ) + 1/2O2 ( g )△H =" +242" kJ/mol |
| B.2H2 ( g ) + O2 ( g ) = 2H2O ( l )△H = -484 kJ/mol |
| C.H2 ( g ) + 1/2O2 ( g ) = H2O ( g )△H =" +242" kJ/mo |
| D.2H2 ( g ) + O2 ( g ) = 2H2O ( g )△H =" +484" kJ/mol |
下列叙述正确的是
| A.物质燃烧不一定是放热反应 |
| B.放热反应不需要从外界吸收任何能量就能发生 |
| C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量 |
| D.化学反应除了生成新的物质外,还伴随着能量的变化 |
如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细。下表所列M、N、P物质中,可以组合成该装置的是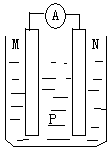
| 选项 |
M |
N |
P |
| A |
锌 |
铜 |
稀硫酸 |
| B |
铜 |
铁 |
稀盐酸 |
| C |
银 |
锌 |
硝酸银溶液 |
| D |
锌 |
铁 |
硝酸铁溶液 |
A、B、C、D四种金属分别用导线两两相连浸入电解液中组成原电池。A、B相连时,A为负极;C、D相连时,电流由D流到C;A、C 相连时,C极上有大量气泡;B、D相连时,D极发生氧化反应。据此判断四种金属的活动性顺序是
A.A>C>D>B B.D>A>B>C C.A>D>C>B D.C>B>A>D
下列事实中,能说明氯原子得电子能力比硫原子强的是
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强②HCl的稳定性比H2S大③Cl2与铁反应生成FeCl3,而S与铁反应生成FeS④Cl2能与H2S反应生成S⑤还原性:Cl-<S2-
| A.①②③④ | B.②③④ | C.①②③④⑤ | D.②③④⑤ |