氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是 。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。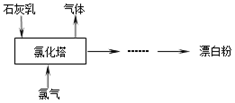
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是 。处理从氯化塔中逸出气体的试剂为 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实 验室里从海藻中提取碘的流程如下:
(1)指出提取过程中有关实验操作的名称:①;③;
(2)操作③用到的主要玻璃仪器
(3)提取碘的过程中,可供选择的有机溶剂是(填选项字母)__________。
| A.水、酒精 | B.四氯化碳、苯 | C.汽油、醋酸 | D.汽油、酒精 |
(4)写出②的离子方程式:
(5)能选用汽油从碘水中提取碘的原因是_______________
A、B、C、D、E五种常见化合物,都是由下面中的离子形成的:阳离子:K+、Na+、Al3+、Fe3+阴离子:HCO3—、SO42—、OH-、 Cl—
为了鉴别上述化合物,分别完成以下实验,其结果是:
① 将它们溶于水后,A为棕黄色溶液,其他均为无色溶液;
② 将它们进行焰色反应,仅有C、E为紫色(透过蓝色钴玻璃);
③ 将B溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
④ 在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有D中放出无色气体,只有A、C中产生白色沉淀;
⑤ 将A、E两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出的化学式:A____,C。
(2)写出B和D反应的离子方程式。
(3)进行焰色反应实验操作时,使用铂丝前应该用________洗涤。
(4)在D溶液中加入少量澄清石灰水,其离子方程式为____
(5)向100mL 1mol/L C溶液中加入0.2 molBa(OH)2溶液,充分反应后得到溶质是
将一只铝制的易拉罐内充满二氧化碳,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口,经过一段时间后,罐壁凹瘪,又过一段时间后,瘪了的罐壁重新鼓起来。
(1)罐壁凹瘪的原因是;
反应的化学方程式是。
(2) 瘪罐重新鼓起来的原因是;
反应的离子方程式是。
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的.流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种.
(1)写出下述物质的结构简式:A:________________,M:________________________.
(2)物质A的同类别的同分异构体为____________.
(3)N+B→D的化学方程式为________________________________________________.
(4)反应类型:X为__________,Y为__________.
感光性高分子也称为“光敏性高分子”,是一种在彩电荧光屏及大规模集成电路制造中应用较广的新型高分子材料,其结构简式为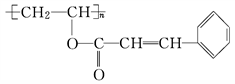
试回答下列问题:
(1)已知它是由两种单体经酯化后聚合而成的,试推断这两种单体的结构简式___________________________、______________________________;
(2)写出在(1)中由两种单体生成高聚物的化学反应方程式:___________________;
(3)对此高聚物的性质判断不正确的是________.
| A.在酸性条件下可以发生水解 |
| B.此高聚物不能使溴水褪色 |
| C.此高聚物可以使高锰酸钾酸性溶液褪色 |
| D.此高聚物可与溴水发生取代反应 |
E.此高聚物水解后可得到另一种高聚物