设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA |
| B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA |
| C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA |
| D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA |
分子式为C10H14的芳香烃,分子中有4个甲基的结构有:
| A.2种 | B.3种 | C.4种 | D.5种 |
化学与生产、生活密切相关。下列有关说法中不正确的是:
| A.油脂的皂化反应一定产生甘油 |
| B.乙醇和乙酸都是常用调味品的主要成分 |
| C.医学上可用CuSO4溶液和NaOH溶液检验糖尿病人尿液中的葡萄糖 |
| D.营养物质----蛋白质、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
直接NaBH4/H2O2燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是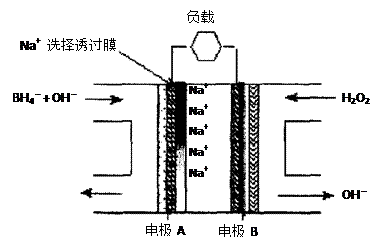
A.电极B材料中包含MnO2层,MnO2可增强导电性
B.电池负极区的电极反应为:
BH4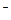 + 8OH
+ 8OH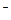 —8e
—8e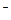 = BO
= BO + 6H2O
+ 6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L 6 mol/LH2O2溶
液,理论上流过电路中的电子为6NA个
一定条件下,某密闭容器中充入等物质的量的A、B两种气体,发生反应:
A(g) + B(g)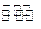 2C(g)。达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如下两图所示。
2C(g)。达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化如下两图所示。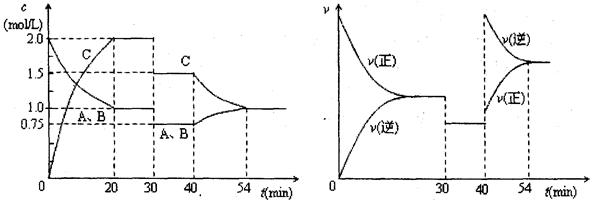
下列说法中正确的是
A.30min时减小容积
B.40min时加入催化剂
C.0~20min内A的平均反应速率为0.05mol·L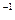 ·min
·min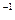
D.正反应为吸热反应
下列离子方程式正确的是
A.过氧化钠与水反应:2O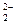 + 2H2O = O2↑ + 4OH + 2H2O = O2↑ + 4OH |
| B.次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4: 3ClO  + 2Fe(OH)3 = 2FeO4 + 2Fe(OH)3 = 2FeO4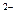 + 3Cl + 3Cl + 4H2O + 4H+ + 4H2O + 4H+ |
C.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO4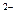 恰好完全沉淀: 恰好完全沉淀:2Al3+ + 3SO4 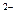 + 3Ba2+ + 6OH + 3Ba2+ + 6OH = 2Al(OH)3↓+ 3BaSO4↓ = 2Al(OH)3↓+ 3BaSO4↓ |
| D.向碳酸氢镁溶液中加入过量的澄清石灰水: |
Mg2+ + 2HCO3 + 2Ca2+ + 4OH
+ 2Ca2+ + 4OH =Mg(OH)2↓+ 2CaCO3↓+ 2H2O
=Mg(OH)2↓+ 2CaCO3↓+ 2H2O