由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:

(1)反应Ⅰ发生反应的化学方程式是 ;
反应Ⅱ发生反应的离子方程式是 ;
(2)操作Ⅲ的实验步骤为 、 ;可循环利用的物质的化学式为 ;
(3)计算用2.5kg含MnO280%的软锰矿制备,理论上可得KMnO4为 :
(4)取制得的产品6.5g,配成250mL溶液;准确称取纯Na2C2O41.34g配成适量溶液。用上述KMnO4溶液滴定Na2C2O4溶液,恰好反应(氧化产物为CO2,还原产物为Mn2+)时,消耗KMnO4溶液的体积为25.00mL。该KMnO4的纯度为 %(保留小树点后一位)。
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32一(aq)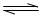 BaCO
BaCO 3(s)+SO42-(aq)(平衡常数K=0.042)
3(s)+SO42-(aq)(平衡常数K=0.042)
(1)现有0.20 mol BaSO4,每次用1.00 L 2.0 mol·L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理次。
(2)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
反应II:CO2(g)+3H2(g);==CH3OH(g)+H2O(g)△H2
(1)上述反应“ 原子经济性”较高的是(填“Ⅰ”或“Ⅱ”)。
原子经济性”较高的是(填“Ⅰ”或“Ⅱ”)。
(2)右表所列数据是反应I在不同温度下的化学平衡
常数(K)。由表中数据判断△H10(填“>”、
“=”或“<”)。
| 温度 |
25℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为,此时的温度为(从上表中选择)。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X,Y是两块电极板,通过导线与直流电源相连。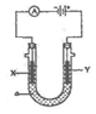
(1)若X是锌,Y是碳棒电极,a是饱和NaCI溶液,则①该原理可制得化工原料有;②Y极的电极反应式为
(2)若要用电解方法精炼粗铜,则①电解液a选用;②Y电极反应式是。(说明:杂质发生的电极反应不必写出)
(3)若要在某铁制小饰品上镀上一层银,则①Y电极的材料是;②X电极反应式是。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中c(Na+)
c(CH3COO-)(填“>”、“=”或“<”)。
(3)常温下,已知某NH4Cl溶液中的c(NH4+)=c(Cl一),则该溶液的pH7(填“>”、“=”或“<”)。
(4)如果将HCl和CH3COONa溶液等浓度、等体积混合,则混合溶液中各离子浓度的大小关系为
下列反应在210℃时达 到平衡:
到平衡:
①PCl5(g)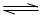 PCl3(g)+C12(g)△H1>0 K1="1" mol·L-1
PCl3(g)+C12(g)△H1>0 K1="1" mol·L-1
②CO(g)+C12(g)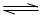 COCl2(g)△H2<O K2=5×104 mol·L-1
COCl2(g)△H2<O K2=5×104 mol·L-1
③COCl2(g) CO(g)+Cl2(g) K3=?
CO(g)+Cl2(g) K3=?
④2SO2(g)+O2(g) 2SO3(g)△H4<0
2SO3(g)△H4<0
(1)反应③的平衡常数K3为 。
。
(2)要使反应①和反应②的K数值相等,可采取的措施是(填序号,下同)。
A.降低反应①、②体系中Cl2浓度
B.反应①降低温度,反应②维持210℃
C.反应①、反应②同时升高温度
(3)欲使反应④向正方向移动,可采取的措施是
A.恒温下扩大容器体积 B.减少SO3的物质的量
C.恒压下升温