2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题: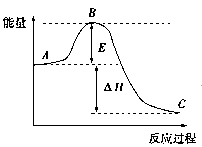
(1)图中A、C分别表示:_________________、__________________;
E的大小对该反应的反应热有无影响?_______________________;
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;
理由是__________________________________________。
(2)图中ΔH=______________kJ/mol,该反应是______________反应(填“吸热”“放热”)。
(3)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(4)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
试计算1 mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:___________________________。
大家知道葡萄糖在乳酸菌的催化作用下,可以生成乳酸,其分子式是C3H6O3。无色透明的乳酸溶液能使紫色石蕊溶液变红色;能够在加热、浓硫酸做催化剂的条件下与乙酸进行酯化反应,则
(1)①乳酸中含有官能团的名称是__________、__________:
②若乳酸中还含有一个甲基(—CH3),则乳酸的结构简式为 ___________________。
(2)写出足量的钠与乳酸反应的化学方程式____________________________________________,
(3)写出乳酸在加热、浓硫酸做催化剂的条件下与乙酸反应的化学方程式_________________。
短周期元素A、B、C、D ,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构;两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两电子层上电子数之和。
(1)元素:A为:B为:C为:
(2)D的质子数和中子数相等。D 的原子组成符号为:它的最高价氧化物对应的水化物的化学式为:。
(3)用电子式表示A、B两元素形成AB2的过程:,用电子式表示C、D两元素形成化学键的过程:
下列变化中①NaCl 溶于水②HCl 溶于水③O2 溶于水④Na2O2溶于水⑤I2升华⑥固体NaOH熔化。未发生化学键破坏的是仅发生离子键破坏的是,仅发生共价键破坏的是既发生离子键破坏,又发生共价键破坏的是(填序号)。
现有下列基本粒子:1H、2H、3H、1H+、40K、40Ca、Cl2、14N、14C,请回答问题:
(1)它们分属种元素,互为同位素的原子为。
(2)质量数相等的粒子为、、(可不填满,也可补充)。
(3)氢的同位素1H、2H、3H与氧的同位素16O、17O、18O相互结合为水,可得水分子的种数为;可得相对分子质量不同的水分子种数为。
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量。下图是部分元素原子的第一电离能I1随原子序数变化的曲线图。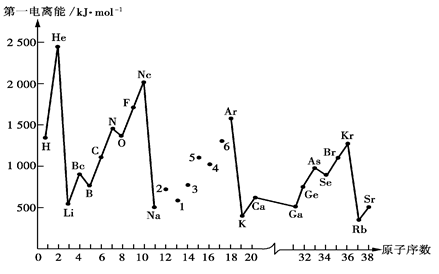
请回答以下问题:
(1)认真分析上图中同周期元素第一电离能的变化规律,将Na——Ar之间六种元素用短线连接起来,构成完整的图像。
(2)从上图分析可知,同一主族元素原子的第一电离能I1变化规律是__________________________;
(3)上图中5号元素在周期表中的位置是___________________________;
(4)上图中4、5、6三种元素的气态氢化物的沸点与同主族上一周期的元素的氢化物比(对应NH3 H2O HF)的沸点低的原因:__________________________________