已知:2Zn(s)+O2(g) 2ZnO(s)ΔH="-701.0" kJ·mol-1
2ZnO(s)ΔH="-701.0" kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH="-181." 6 kJ·mol-1
2HgO(s)ΔH="-181." 6 kJ·mol-1
则反应Zn(s)+HgO(s)==ZnO(s)+Hg(l)的ΔH为
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
钢铁发生吸氧腐蚀时,正极上发生的电极反应是 ( )
| A.2H++2e-=H2↑ | B.Fe2++2e-=Fe |
| C.2H2O+O2+4e-=4OH- | D.Fe3++e-=Fe2+ |
如图是关于反应A2(g)+3B2(g) 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是()
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是()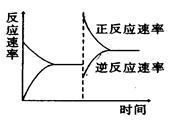
| A.升高温度,同时加压 | B.降低温度,同时减压 |
| C.增大反应物浓度,同时减小生成物浓度 | D.增大反应物浓度,同时使用催化剂 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A.Z为0.3mol/L | B.Y2为0.4mol/L | C.X2为0.2mol/L | D.Z为0.4mol/L |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是()
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和一元强碱溶液反应 |
已知:4NH3(g)+5O2(g) ==4NO(g)+6H2O(g)△H="-1" 025kJ/mol,该反应是一个可逆反应。若反应物 起始物质的量相同,下列关于该反应的示意图不正确的是()