下列叙述I和II均正确并有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
溶解度:CaCO3<Ca(HCO3)2 |
溶解度:Na2CO3<NaHCO3 |
| B |
盐酸的酸性强于氢硫酸 |
氯元素比硫元素非金属性强 |
| C |
SiO2可与HF反应 |
氢氟酸不能保存在玻璃瓶中 |
| D |
Ca(OH)2能制成澄清石灰水 |
可配制2.0 mol∙L-1的Ca(OH)2溶液 |
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是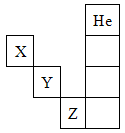
①X的气态氢化物与Y的最高价氧化物对应的水化物所生成的盐属于离子化合物
②Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质在常温下是液体,可与镁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有18种元素
| A.①②③④ | B.①②③④⑤ | C.只有③⑤ | D.只有①④ |
学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
| A |
B |
C |
D |
|
| 纸蝴蝶上的喷洒液 |
石蕊 |
酚酞 |
酚酞 |
石蕊 |
| 小烧坏中的溶液 |
浓盐酸 |
浓氨水 |
氢氧化钠溶液 |
浓硫酸 |
A和M为两种元素,已知A位于短周期,且M—与A2+的电子数之差为8,则下列说
法一定正确的是
| A.A和M的原子序数之差为6 | B.A和M原子的最外层电子数之和为9 |
| C.A和M原子最外层电子数之差为7 | D.A和M原子的电子总数之和可能为11 |
对于X—O—H型化合物而言,X是除H.O外的其它元素时,下列说法中正确的是
| A.X—O—H的水溶液不能导电 |
| B.X—O—H一定是强酸 |
| C.当X是活泼金属时,它一定是强碱 |
| D.X—O—H一定是共价化合物 |
某原子核外共有n个电子层(n>3),则(n-1)层最多容纳的电子数为
| A.8个 | B.18个 | C.32个 | D.2(n-1)2个 |