(14+2分)已知元素X、Y、Z、W、Q均为短周期元素,原子序数依次增大。X基态原子的核外电子分布在3个能级,且各能级电子数相等,Z是地壳中含量最多的元素,W是电负性最大的元素,元素Q的核电荷数等于Y、W原子的最外层电子数之和。另有R元素位于元素周期表第4周期第Ⅷ族,外围电子层有2个未成对电子。请回答下列问题。
(1)微粒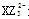 的中心原子杂化类型为 ,化合物YW3的空间构型为 。
的中心原子杂化类型为 ,化合物YW3的空间构型为 。
(2)R基态原子的电子排布式为 。
(3)一种新型超导晶体的晶胞如图所示,则该晶体的化学式为 ,
其中一个Q原子紧邻 个R原子。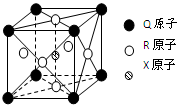
(4)R的氢氧化物能溶于含XY-离子的溶液生成一种配离子[R(XY)4]2-,该反应的离子方程式是 。弱酸HXY分子中存在的σ键与π键的数目之比为 。
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S)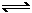 PH3(g) + HI(g)①;
PH3(g) + HI(g)①;
4PH3(g) 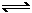 P4(g)+ 6 H2(g)②;
P4(g)+ 6 H2(g)②;
2HI(g) H2(g) + I2(g)③
H2(g) + I2(g)③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
(1)平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)=,n(PH3)=。
(2)a,b,c三者的关系服从a >(填含b,c的代数式)。
(3)平衡后,增大压强,容器内n(I2),n(PH4I)(增加、减少、不变)
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。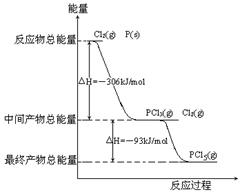
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的△H3=_______,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________________。
在一定的温度下,把2体积N2和6体积H2分 别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图)。
容器中发生如下反应:N2+3H2  2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
2NH3;△H<0。反应达到平衡后,测得混合气体为7体积。
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。那么:
①a=1,c=2,则b==。在此情况下,反应起始时将向方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是,原因是______________________________。
现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
t2:;
t3:;
t4:。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比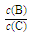 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______;而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。