240 mL浓度为5 mol/L的Na2SO3的溶液,恰好被200 mL浓度为2 mol/L的K2Cr2O7溶液完全反应,则元素铬在被还原的产物中的化合价是
| A.+6 | B.+3 | C.+4 | D.+2 |
在固定体积的密闭容器中进行如下反应:2SO2(g) + O2(g)  2 SO3(g)。已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是()
2 SO3(g)。已知反应过程某一时刻SO2,O2,SO3浓度(mol/L)分别为0.2,0.1,0.2,达到平衡时,浓度可能正确的是()
| A.SO2,O2分别为0.4,0.2mol/L | B.SO2为0.25mol/L |
| C.SO2,SO3均为0.15mol/L | D.SO3为0.4mol/L |
“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是()
| A.蛋白质和脂肪 | B.蛋白质和高级烃 | C.淀粉和油脂 | D.纤维素和油脂 |
实现下列变化的有机反应的类型,不正确的是
| A.CH3CH3 →CH3CH2Cl 取代反应 | B.CH2==CH2→CH2BrCH2Br 加成反应 |
| C.CH2==CH2→CH3CH2OH 取代反应 | D.CH≡CH→CHBr==CHBr 加成反应 |
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。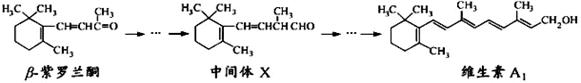
下列说法正确的是()
| A.β—紫罗兰酮可使酸性KMnO4溶液褪色 |
| B.1mol中间体X最多能与2molH2发生加成反应 |
| C.维生素A1难溶于水 |
| D.β—紫罗兰酮与中间体X互为同分异构体 |
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如右图所示。下列说法错误的是()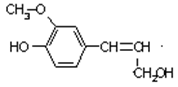
| A.该物质的分子式是C10H12O3,属于芳香烃 |
| B.该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
| C.1mol该物质最多能消耗4mol H2 |
| D.1mo该物质与溴水发生反应,可消耗4mol Br2 |