下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
| A.4KI+O2+2H2O=4KOH+2I2 |
| B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca |
| C.I2+2NaClO3=2NaIO3+Cl2 |
D.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
下列各组元素中,属于同一周期的是
| A.Na、Li | B.N、Cl | C.Si、S | D.O、P |
某微粒用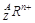 表示,下列关于该微粒的叙述正确的是
表示,下列关于该微粒的叙述正确的是
| A.所含质子数=A-n | B.所含中子数=A-Z |
| C.所含电子数=Z+n | D.质量数=Z+A |
放射性同位素钬166 67Ho的原子核内的中子数与核外的电子数之差是
| A.32 | B.67 | C.99 | D.166 |
下列元素中不属于主族元素的是
| A.磷 | B.钙 | C.铁 | D.碘 |
下列有关晶体的说法
①依据构成粒子的堆积方式可将晶体分为金属晶体、离子晶体、分子晶体、原子晶体;
②由原子直接构成的晶体就是原子晶体;
③分子晶体的堆积均采取分子密堆积;
④SiF4、NaF、MgF2三种晶体的熔点依次升高;
⑤金属键只存在于金属晶体中;
⑥离子键只存在于离子晶体中;
⑦H2O的性质非常稳定,原因在于分子之间存在氢键;
⑧SO2和SiO2晶体在熔化时破坏的作用力不相同。
其中一定正确的有
| A.3种 | B.4种 | C.5种 | D.6种 |