下列有关硅元素的叙述中,正确的是
| A.水玻璃可用作木材防火剂 | B.SiO2是良好的半导体材料 |
| C.硅是地壳中含量最多的元素 | D.SiO2不溶于水,也不溶于任何酸 |
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+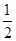 O2(g)==="CO(g)" ΔH=-110.5 kJ·mol-1
O2(g)==="CO(g)" ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
| A.+80.5 kJ·mol-1 | B.+30.0 kJ·mol-1 |
| C.-30.0 kJ·mol-1 | D.-80.5 kJ·mol-1 |
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为 ( )。
A.Ba2+(aq)+SO (aq)===BaSO4(s)ΔH=-2.92 kJ·mol-1 (aq)===BaSO4(s)ΔH=-2.92 kJ·mol-1 |
B.Ba2+(aq)+SO (aq)===BaSO4(s)ΔH=-18 kJ·mol-1 (aq)===BaSO4(s)ΔH=-18 kJ·mol-1 |
C.Ba2+(aq)+SO (aq)===BaSO4(s)ΔH=-73 kJ·mol-1 (aq)===BaSO4(s)ΔH=-73 kJ·mol-1 |
D.Ba2+(aq)+SO (aq)===BaSO4(s)ΔH=-0.72 kJ·mol-1 (aq)===BaSO4(s)ΔH=-0.72 kJ·mol-1 |
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是 ( )。
| A.每生成2分子AB吸收b kJ热量 |
| B.该反应热ΔH=+(a-b)kJ·mol-1 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量 |
下列关于能量的变化及反应热的说法中正确的是 ( )。
| A.任何化学反应都有反应热 |
| B.有些化学键断裂时吸收能量,有些化学键断裂时放出能量 |
| C.新化学键的形成不一定放出能量 |
| D.有热量变化的反应一定有化学键的断裂与形成 |