(8分)钠、铝、铁是三种重要的金属。请回答:
(1)钠元素的金属性比铝的________(填“强”或“弱”)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ;可观察到的实验现象是______(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)Fe跟Cl2在一定条件下反应,所得产物的化学式是________。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成________色。
b.向另一支试管中滴加NaOH溶液,现象为___________________________,
反应的离子方程式是________________________________________________。
(1)某温度时,水的离子积Kw=1×10-13,则该温度_________25℃(填“>”、“<”或“=”)。在此温度下,某溶液中由水电离出来的H+浓度为1×10-10 mol•L-1,则该溶液的pH可能为________;
(2)若温度为25℃时,体积为Va、pH=a的H2SO4与体积为Vb、pH=b的NaOH混合,恰好中和,此溶液中各种离子的浓度由大到小的排列顺序是_____________。
(12分)乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解。
(1)探究草酸的酸性
①已知:25℃ H2C2O4 K1=5.4×10-2,K2=5.4×10-5;H2CO3 K1=4.5×10-7 K2= 4.7×10-11
下列化学方程式正确的是
A.H2C2O4+CO32-= HCO3-+HC2O4- B.HC2O4-+CO32-= HCO3-+C2O42-
C.H2C2O4+CO32-= C2O42-+H2O+CO2 D.2C2O42-+CO2+H2O = 2HC2O4-+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是 。
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)="2" c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定Na2C2O4求算Na2C2O4的纯度。
实验步骤:准确称取1gNa2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中。再向瓶中加入足量稀H2SO4 ,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在 滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是: 。
③下列操作可能使测量结果偏高的是
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视
D.锥形瓶中残留少量水
④计算Na2C2O4的纯度
汽车尾气中排放的NO和CO,可以通过加装催化转化器,使之转化为两种无污染的气体,
2NO(g)+2CO(g) N2(g)+2CO2(g)ΔH=-748 kJ/mol
N2(g)+2CO2(g)ΔH=-748 kJ/mol
在一定温度下,向2L的密闭容器中充入2.0molNO2.0molCO,在催化剂作用下发生反应,相关数据如下:
| 0 min |
5min |
10min |
15min |
20min |
|
| c(NO) |
1.0 |
0.6 |
0.3 |
0.2 |
0.2 |
| c(N2) |
0 |
0.2 |
0.35 |
0.4 |
0.4 |
(1)5—10min,用CO的浓度变化表示的反应速率为: ;
(2)能说明上述反应达到平衡状态的是
A.2n正(NO) =n逆(N2)B.混合气体的平均相对分子质量不变
C.NO和CO的转化率相等D.容器内气体压强不变
(3)20min时,向容器中加入1molNO和1molCO,再次达到平衡时,NO的转化率: (填“变大”、“ 变小”或“不变”)。
(4)计算此温度下的化学平衡常数K= ,或保持温度不变,此时再向容器内加入CO和CO2各1mol,平衡 移动(填“向左”、“ 向右”或“不”)。
(5)若反应开始向容器中加入1molN2和2molCO2,反应达到平衡时,吸收热量为 kJ。
(1)用石墨电极电解一定浓度的CuSO4溶液,一段时间后,向所得溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度,电解过程中,阴极的电极反应式为 ;阳极产生的气体质量为 。
(2)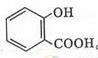 的名称为: ;在核磁共振氢谱中会出现 组峰;写出其与KHCO3溶液反应的化学方程式: 。
的名称为: ;在核磁共振氢谱中会出现 组峰;写出其与KHCO3溶液反应的化学方程式: 。
(3)写出由对苯二甲酸与乙二醇在催化剂作用下聚合生成涤纶的化学方程式: 。
【化学——选修3:物质结构与性质】
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
(2)四(三苯基膦)钯分子结构如下图:
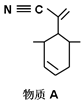
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___________;判断该物质在水中溶解度并加以解释_______________________。该物质可用于右上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________________;一个A分子中手性碳原子数目为__________________。
(3)在图示中表示出四(三苯基膦)钯分子中配位键:
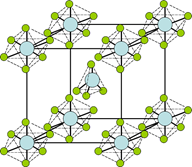
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为 ;正四面体形阳离子中键角小于PCl3的键角原因为__________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_________g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因 。