反应A+B→C ΔH<0分两步进行:①A+B→X ΔH>0,②X→C ΔH<0。下列示意图中,能正确表示总反应过程中能量变化的是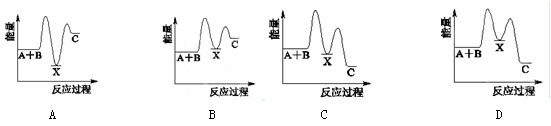
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+.下列说法正确的是
A. 它们互称为同素异形体 它们互称为同素异形体 |
| B.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI═2CeI3+3H2↑ |
| C.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| D.工业上金属铈一般保存在敞口容器中 |
碘在地壳中主要以NaI3的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.下列说法中不正确的是
| A.用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉-KI试纸褪色的原因可能是:5Cl2+I+6H2O═2HI03+10HCl |
| C.途径Ⅱ中若生成1 molI2,则反应中转移的电子数为10NA |
| D.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3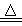 2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
下列说法不正确的是
| A.将某气体通入品红溶液中,品红溶液褪色,该气体不一定是SO2 |
| B.因为亚硫酸的酸性强于碳酸,所以硫的非金属性比碳强 |
| C.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 |
| D.依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
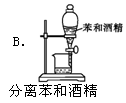
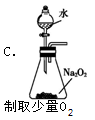
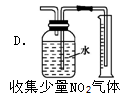
下列装置能达到相应实验目的是