(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质的是 。
①亚硫酸溶液 ②次氯酸钠 ③氯化氢气体 ④蔗糖 ⑤硫酸钡
⑥氨气 ⑦冰醋酸 ⑧硫酸氢钠固体 ⑨氢氧化铁 ⑩NO2
(2)写出下列物质在水中的电离方程式
亚硫酸: ;次氯酸钠: ;
(3)甲、乙两瓶氨水的浓度分别为1mol·L-1、0.1mol·L-1,则c(OH-)甲:c(OH-)乙 10(填“大于”、“等于”或“小于”)。
(4)下表数据均在相同温度下测得,由此可知三种酸的酸性由强到弱的顺序为
| |
HX |
HY |
HZ |
| 浓度 mol·L-1 |
0.1 0.5 |
1.0 1.5 |
2.0 2.5 |
| 电离度 |
0.3% 0.13% |
0.3% 0.24% |
0.5% 0.45% |
(5)NO2与NO之间存在如下可逆反应:2NO2 2NO+O2。T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是
2NO+O2。T℃时,在一恒容密闭容器中充入适量NO2,反应达到平衡状态的标志是
①混合气体的颜色不再改变的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④混合气体的平均相对分子质量不再改变的状态
⑤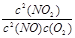 的比值不再改变的状态
的比值不再改变的状态
榴石矿石可以看作 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
(1)榴石矿加盐酸溶解后,溶液里除了 外,还含有的金属离子是。
外,还含有的金属离子是。
(2)对溶液I进行操作时,控制溶液PH=9~10(有关氢氧化物沉淀的PH见下表)
NaOH不能过量,若NaOH过量可能会导致溶解,沉淀。
(3)写出向沉淀物A中加入过量氢氧化钠溶液的离子方程式。
(4)①某同学在实验室中用图I装置制取 气体并通入溶液II中,结果没有沉淀产生,可能的原是;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为。
气体并通入溶液II中,结果没有沉淀产生,可能的原是;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为。
②若将二氧化碳气体通入澄清石灰水中,石灰水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示该溶解平衡关系。
运用相关原理,回答下列各小题:
已知: 在水中的电离方程式为
在水中的电离方程式为
(1)常温下,PH=5的 溶液中水的电离程度PH=9的
溶液中水的电离程度PH=9的 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的 与氨水混合后,溶液呈酸性的原因为。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为。(用离子方程式表示);若一定量的 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则
 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH=7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH=7(填“>”、”=”或“<”)
(3)将分别含有 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
①若 离子有剩余,上述四种离子在溶液中还存在的有,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有,
一定不存在的离子有。
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖, 。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
。右图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
(1)此反应在50~60s时化学平衡常数为 =(列出计算式不用试算)。
=(列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
在该条件下,氮气的化学反应速率(填“变小”、“变大”或“不变”)
(3)该反应在80S后化学平衡常数为 ,则
,则
 (填“>”,“<”或“=”),此时氮气的转化率为。
(填“>”,“<”或“=”),此时氮气的转化率为。
(4)若在110s后向该平衡体系中再加入1mol氨气,则再次达平衡后,氨气在平衡体系中的体积分数。(填“变小”、“变大”或“不变”)
工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:

则反应 的
的 。
。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使 难放电、阳极电极不溶解)。写出电解总方程式。
难放电、阳极电极不溶解)。写出电解总方程式。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的极发生反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为
,消耗硫酸的物质的量是。
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示:
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲。
⑶样品中(NH4)2CO3的质量分数是 ▲%(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲。