A、B、C、D、E五种短周期元素的原子序数依次增大,A原子为半径最小的原子,C原子最外层电子数与A、B原子最外层电子数之和相等,D原子和B原子最外层电子数之和为C原子最外层电子数的2倍,D原子的最外层电子数为电子层数的3倍,A、E同主族。下列说法正确的是
A.原子半径大小顺序为:E>D>C>B>A
B.A、B、C、D四种元素都属于非金属元素,它们之间只能形成共价化合物
C.B、C、D、E四种元素与A元素形成的最简单化合物的沸点依次升高
D.D与A、E均可形成具有强氧化性的化合物,可用于城市自水的杀菌消毒
如图是关于N2+3H2 2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是
2NH3 ΔH<0的速率—时间图象,则t1时刻使平衡发生移动的原因是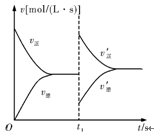
| A.升高温度,同时增大压强 |
| B.降低温度,同时减小压强 |
| C.增大反应物的浓度,同时使用适宜的催化剂 |
| D.增大反应物的浓度,同时减小生成物的浓度 |
W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y。下列说法正确的是
| A.Y的低价氧化物与O3漂白的原理相同 |
| B.Y的氢化物和W2Y所含化学键的类型相同 |
| C.上述三种元素形成的简单离子,X离子半径最小 |
| D.工业上常用电解相应的盐溶液制备W、X的单质 |
某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是
A.c(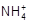 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
B.c(Cl-)>c(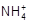 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.c(Cl-)>c(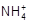 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.c(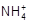 )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
下列各组离子在指定溶液中一定能够大量共存的是
| A.pH=12的溶液中:K+,Na+,AlO2—,S2—,SO32— |
| B.无色溶液中:K+,Cl—,MnO4—,PO43—,SO4 2— |
| C.水电离的H+浓度C(H+)=10—12mol·L—1的溶液中:ClO-,SO42- ,NO3-,NH4+,Na+ |
| D.某强酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl— |
关于氢键,下列说法正确的是
| A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |
| B.氯化钠易溶于水是因为形成了氢键 |
| C.氨易液化与氨分子间存在氢键无关 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |